Содержание
- 2. 27 Твердое вещество А растворили в воде и полученный раствор обработали соляной кислотой. Полученный раствор выпарили,
- 3. 27 Немного о реакциях…. Щелочные металлы – это I группа, А - главная подгруппа – Li,
- 4. 28 Немного о реакциях…. В зависимости от активности металла, реакция протекает при различных условиях и образуются
- 5. 27 Твердое вещество А растворили в воде и полученный раствор обработали соляной кислотой. Полученный раствор выпарили,
- 7. Скачать презентацию
Слайд 227
Твердое вещество А растворили в воде и полученный раствор обработали соляной кислотой.
27
Твердое вещество А растворили в воде и полученный раствор обработали соляной кислотой.

Предложите 3 примера вещества А, удовлетворяющего условиям задачи. Напишите уравнения упомянутых реакций укажите, что будет наблюдаться при протекании всех этих процессов (при растворении А в воде и дальнейшем взаимодействии раствора с соляной кислотой). Рассчитайте, во сколько раз масса полученного хлорида лития будет больше (или меньше), чем масса исходного вещества А.
Слайд 327
Немного о реакциях….
Щелочные металлы – это I группа, А - главная подгруппа – Li, Na, K, Rb, Cs, Fr
Щелочно-земельные металлы – это II группа,
27
Немного о реакциях….
Щелочные металлы – это I группа, А - главная подгруппа – Li, Na, K, Rb, Cs, Fr
Щелочно-земельные металлы – это II группа,

n I
Основания – это сложные вещества с общей формулой Ме(ОН)n
ОН – гидроксильная группа, с валентностью (I)
Щёлочи – это растворимые в воде основания (см. ТАБЛИЦУ РАСТВОРИМОСТИ)
I n
Кислоты – это сложные вещества с общей формулой Нn (КО)
(КО) – кислотный остаток
V-VII
Кислотный оксид – неМех Оу и Мех Оу
I, II
Основные оксиды – Мех Оу
Вода реагирует с:
Металлами
Оксидами металлов
Оксидами неметаллов
Неметаллами
Слайд 428
Немного о реакциях….
В зависимости от активности металла, реакция протекает при различных условиях
28
Немного о реакциях….
В зависимости от активности металла, реакция протекает при различных условиях

1). Взаимодействие с самыми активными металлами, стоящими в периодической системе в I А и I I А группах (щелочные и щелочно-земельные металлы) и алюминий. В ряду активности эти металлы расположены до алюминия (включительно)
Реакция протекает при обычных условиях, при этом образуется щелочь и водород.
I I
2Li + 2 H2O = 2 Li OH + H2 (протекает реакция замещения)
HOH гидроксид
лития
I I I
Ba + 2 H2O = Ba (OH)2 + H2
2 Al + 6 H2O = 2 Al (OH)3 + 3 H2
гидроксид
алюминия
ОН – гидроксогруппа, она всегда одновалентна
ВЫВОД – активные металлы - Li, Na, K, Rb, Cs, Fr, Ca, Sr, Ba, Ra + Al – реагируют так
Me + H2O = Me(OH)n + H2
Вода реагирует с:
Металлами
Оксидами металлов
Оксидами неметаллов
Неметаллами
Слайд 527
Твердое вещество А растворили в воде и полученный раствор обработали соляной кислотой.
27
Твердое вещество А растворили в воде и полученный раствор обработали соляной кислотой.

Предложите 3 примера вещества А, удовлетворяющего условиям задачи. Напишите уравнения упомянутых реакций укажите, что будет наблюдаться при протекании всех этих процессов (при растворении А в воде и дальнейшем взаимодействии раствора с соляной кислотой). Рассчитайте, во сколько раз масса полученного хлорида лития будет больше (или меньше), чем масса исходного вещества А.
Варианты вещества А: Li, Li2O, LiCl, LiOH, Li2CO3. Если в формуле исходного вещества А входит 1 атом лития, то количества веществ А и LiCl равны. Значит, массы относятся как молярные массы. М(LiCl) /М( Li) = 42,5/7=6,07; М(LiCl) /М( LiOH) = 42,5/24=1,77, LiCl = 1. Если атомов лития два, то хлорида лития будет по молям в два раза больше. Отношение для оксида лития – (85/30=2,83), для карбоната лития – (85/74=1,487).
 Окислительновосстановительные индикаторы. Задача 12 Команда: Мастера Беспорядка
Окислительновосстановительные индикаторы. Задача 12 Команда: Мастера Беспорядка Химические формулы
Химические формулы Презентация на тему Теория строения органических соединений А.М. Бутлерова
Презентация на тему Теория строения органических соединений А.М. Бутлерова  Химия элементов (лекция 5)
Химия элементов (лекция 5) Строение вещества. Химическая связь и кристаллическое строение. Урок 1: Ионная и ковалентная связи
Строение вещества. Химическая связь и кристаллическое строение. Урок 1: Ионная и ковалентная связи Презентация на тему Химия в повседневной жизни человека
Презентация на тему Химия в повседневной жизни человека  Строение углеводородов
Строение углеводородов Презентация на тему Фосфор
Презентация на тему Фосфор  Полимеры
Полимеры Презентация по Химии "Конструкции из стекла"
Презентация по Химии "Конструкции из стекла"  Подготовила Ковальчук О.М. учитель химии высшей квалификационной категории
Подготовила Ковальчук О.М. учитель химии высшей квалификационной категории Виды работ на уроках химии
Виды работ на уроках химии Каких заданий не бывает на ЕГЭ по химии и почему
Каких заданий не бывает на ЕГЭ по химии и почему Изменения в составе ядра атома Задачи урока: Познакомиться с понятием «ядерные процессы», «изотопы» Развить понятие «Химически
Изменения в составе ядра атома Задачи урока: Познакомиться с понятием «ядерные процессы», «изотопы» Развить понятие «Химически Электролитическая диссоциация
Электролитическая диссоциация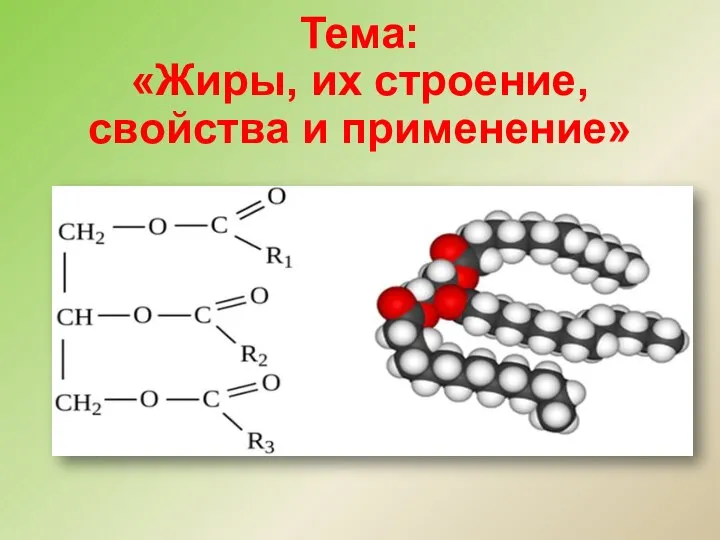 Жиры, их строение, свойства и применение
Жиры, их строение, свойства и применение Расчеты по уравнениям химических реакций
Расчеты по уравнениям химических реакций Вода. Строение молекулы воды. Анализ и синтез воды
Вода. Строение молекулы воды. Анализ и синтез воды Комплексонометрическое титрование. Часть 2. Лекция 6
Комплексонометрическое титрование. Часть 2. Лекция 6 Металлы. Общая характеристика ( 9 класс)
Металлы. Общая характеристика ( 9 класс) Химическая викторина
Химическая викторина Строение вещества. Химическая связь
Строение вещества. Химическая связь Электролиз и его применение
Электролиз и его применение Классификация углеводов: моносахариды, дисахариды, полисахариды. Химическая структура. Свойства и функция углеводов
Классификация углеводов: моносахариды, дисахариды, полисахариды. Химическая структура. Свойства и функция углеводов Презентация на тему Альдегиды
Презентация на тему Альдегиды  Химия природная или синтетическая. За и против
Химия природная или синтетическая. За и против Основные полимеры, используемые для производства электроизоляционных материалов и пропиточных составов
Основные полимеры, используемые для производства электроизоляционных материалов и пропиточных составов Химические свойства кислот. 11 класс
Химические свойства кислот. 11 класс