Содержание
- 2. Воспитательное стихотворение (Эдуард Успенский – создатель брэнда «Чебурашка») Когда гуляю пешком по поселку И вижу розарий,
- 3. Правила поведения Не опаздывать на лекцию Отключить сотовые телефоны в аудитории Поздороваться с лектором Не шуметь
- 4. Советы Регулярно посещать лекции Записать в тетради лишь самое главное Стремиться понять лектора Учиться не только
- 5. Признаки химической реакции изменение цвета (J2 и крахмал, Fe3+ и роданиды, «лисий хвост», KMnO4) появление запаха
- 6. «…Широко простирает химия руки свои в дела человеческие…» Выделение газа, изменение окраски, образование осадка, изменение массы
- 7. Необычные химические воздействия и превращения Механохимия SnO2 + C = Sn + CO2 4Al + 3CO2
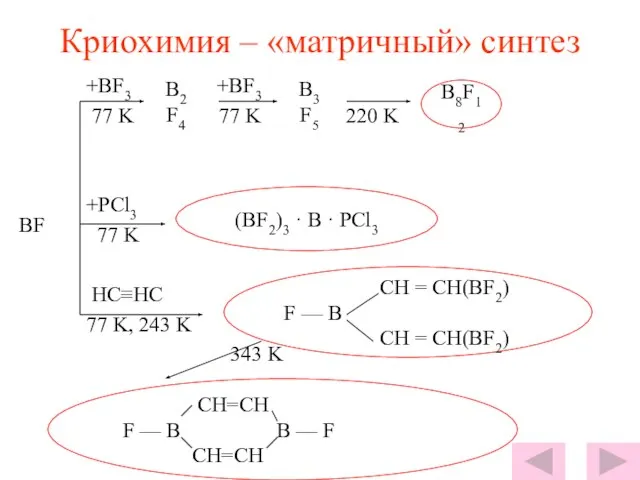
- 8. Криохимия – «матричный» синтез +BF3 +BF3 77 K 77 K 220 K +PCl3 77 K HC≡HC
- 9. Особенности химического творчества Манхэттенский проект атомная бомба Проект Апполон человек на луне Результат деятельности крупных коллективов
- 10. химия медицина биология геология механика физика Химия - в центре наук
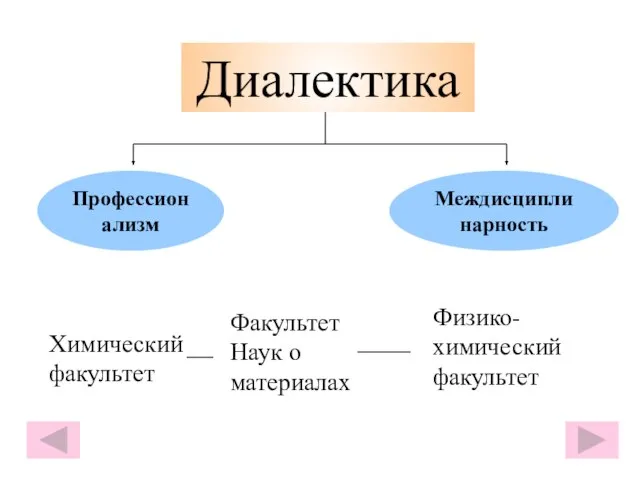
- 11. Диалектика Профессионализм Междисциплинарность Химический факультет Факультет Наук о материалах Физико-химический факультет
- 12. Пикосекунды - фемтохимия 2Fe2O3 + 3C → 4Fe + 3CO2 Нанометр – нанохимия Нанотехнология АСМ, ЭМ
- 13. Лекция № 1: Энергетика химических превращений
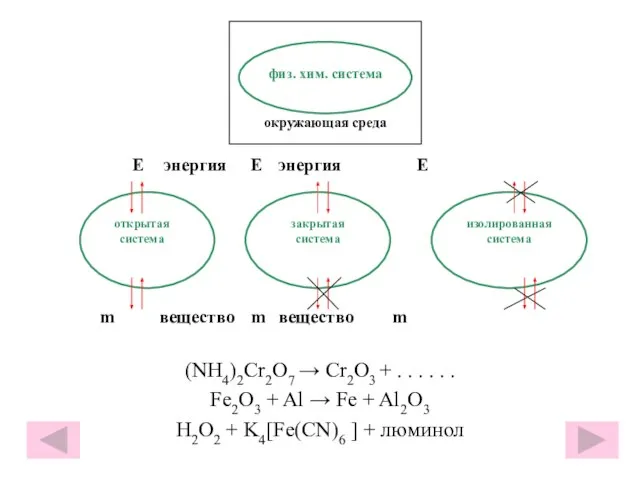
- 14. Е энергия Е энергия Е m вещество m вещество m (NH4)2Cr2O7 → Cr2O3 + . .
- 15. Внутренняя энергия энергия межмолекулярного взаимодействия энергия химической связи энергия взаимодействия электронов и ядер внутриядерная энергия кинетическая
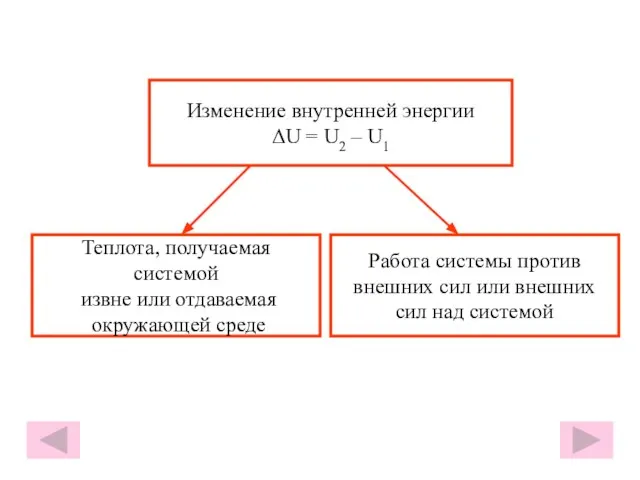
- 16. Изменение внутренней энергии ΔU = U2 – U1 Теплота, получаемая системой извне или отдаваемая окружающей среде
- 17. Первое начало термодинамики ∆U=U2 – U1 = Q – A (1.1) A = p ∆V= p
- 18. при р = const ( изобарный процесс ) ∆U = U2 – U1 = Qр –
- 19. Из (1.5) и (1.6) (1.7) Из (1.3) и (1.4) Qр – Qv = p·∆V = ∆(p·V)
- 20. Для реакций: H2 + Cl2 = 2HCl ∆nг = 0, Qр = Qv 2H2 + O2
- 21. С + 2S = CS2 – 88кДж (1.12) С + 2S + 88кДж = CS2 (1.12׀)
- 22. H2O(г) + С(тв) = СО(г) + Н2(г) (1.13) ∆Н = (Н(СО)+ Н(Н2 )) – (Н(H2O)+ Н(С))
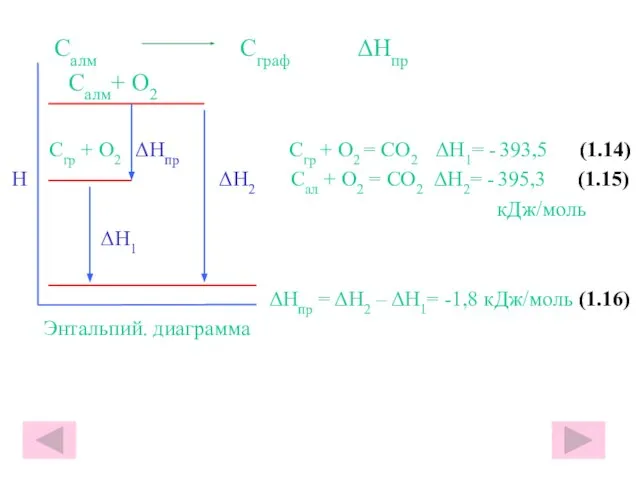
- 23. Салм Сграф ΔHпр Салм+ О2 Сгр + О2 ΔHпр Сгр + О2 = СО2 ΔH1= -
- 24. Энтальпия (теплота) образования станд. условия ΔHºобр, 298 или ΔHºf, 298 1 атм. = 101325 Па 25ºС
- 25. Тепловой эффект растворения ΔHºраств. KOH(кр) = K+(р) + OH-(р) (1.19) ΔHºf,298 - 425.8 – 251.2 –
- 26. Энергия ионизации атомов H(г) = H+(г) + e- (1.21) ΔHºf,298 218.0 1536.2 ΔHºион = Jион =
- 27. Закон Лавуазье – Лапласа ΔHпр = - ΔHобр (Cl2O, ClO2, Cl2O7)
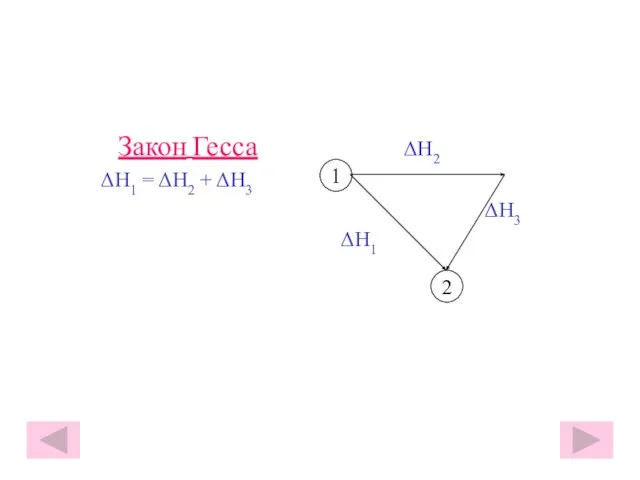
- 28. Закон Гесса ΔH2 ΔH1 = ΔH2 + ΔH3 ΔH3 ΔH1 2 1
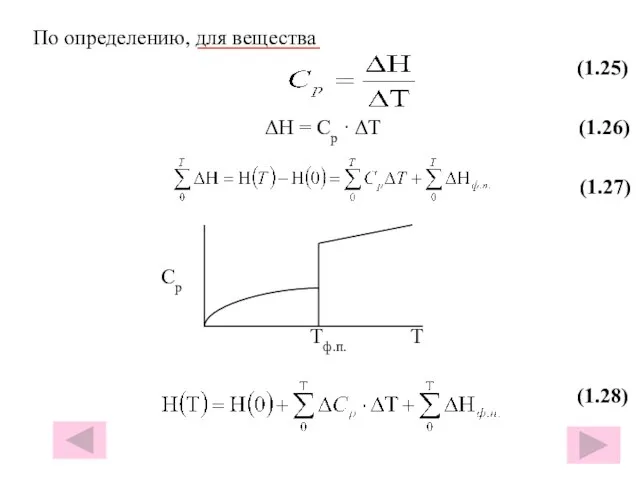
- 29. По определению, для вещества (1.25) ΔH = Cp · ΔT (1.26) (1.27) Cр Тф.п. Т (1.28)
- 30. Для реакции (ур. Кирхгофа) (1.29) (1.30) (1.31) для твердых веществ с = 0, газов d =
- 31. Энергия химической связи EHCl = ? (EHCl = - ΔHH-Cl) ΔHf,HCl = - 92,8 (ΔHдисс)H2 =
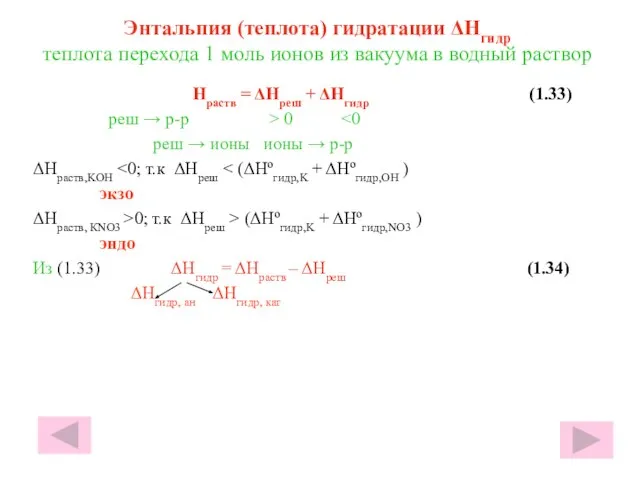
- 32. Энтальпия (теплота) гидратации ΔHгидр теплота перехода 1 моль ионов из вакуума в водный раствор Hраств =
- 33. Генерация, хранение, транспорт энергии ТЭЦ, ЭС, АС, генер. схема экоэнергетики Альтернативы? Водород, энергетика Генерация H2 из
- 34. FeCl3 · 6H2O Тпл = 310 К ∆Η = 336 кДж/моль LiF + LiOH Тпл =
- 35. Академик H. H. Семенов - один из наиболее ярких представителей советской науки, внесший неоценимый вклад в
- 37. Скачать презентацию

























 Кислородосодержащие органические вещества
Кислородосодержащие органические вещества Менделеевский период
Менделеевский период Презентация на тему Угольная и кремниевая кислоты и их соли
Презентация на тему Угольная и кремниевая кислоты и их соли  Химические свойства воды
Химические свойства воды Практика по химии
Практика по химии Бензол
Бензол Химия в быту
Химия в быту Биологически важные реакции монофункциональных соединений. Реакционная способность альдегидов, кетонов, карбоновых кислот
Биологически важные реакции монофункциональных соединений. Реакционная способность альдегидов, кетонов, карбоновых кислот Окислительно- восстановительные реакции в органической химии. Подготовка к ЕГЭ
Окислительно- восстановительные реакции в органической химии. Подготовка к ЕГЭ Алкены. Тестирование
Алкены. Тестирование Химическое ассорти
Химическое ассорти Водорастворимые витамины. 7 свойств водорастворимых витаминов
Водорастворимые витамины. 7 свойств водорастворимых витаминов Обобщение знаний об углеводородах
Обобщение знаний об углеводородах История развития органической химии
История развития органической химии Понятие фазы вещества. Насыщенный пар и его свойства. Влажность воздуха. Приборы для измерения влажности воздуха
Понятие фазы вещества. Насыщенный пар и его свойства. Влажность воздуха. Приборы для измерения влажности воздуха Презентация на тему Общая характеристика металлов главных подгрупп I-III
Презентация на тему Общая характеристика металлов главных подгрупп I-III  1_
1_ Коагуляция в дисперсных системах
Коагуляция в дисперсных системах Серная кислота
Серная кислота Переработка нефти. 10 класс
Переработка нефти. 10 класс Получение серной кислоты
Получение серной кислоты Альфа и бета распад. Правило смещения
Альфа и бета распад. Правило смещения Презентация на тему Углекислый газ
Презентация на тему Углекислый газ  Презентация на тему Химия и стирка
Презентация на тему Химия и стирка  Гипер-гипофосфатемия
Гипер-гипофосфатемия Оксиген та кисень
Оксиген та кисень Алициклические и гетероциклические соединения. Тема № 7, 8
Алициклические и гетероциклические соединения. Тема № 7, 8 Классы неорганических соединений (основания)
Классы неорганических соединений (основания)