Содержание
- 2. Что такое ГИДРОКСИДЫ и как их классифицируют?
- 3. Индикатор ЛАКМУС в разных средах: ЩЕЛОЧЬ КИСЛОТА ВОДА
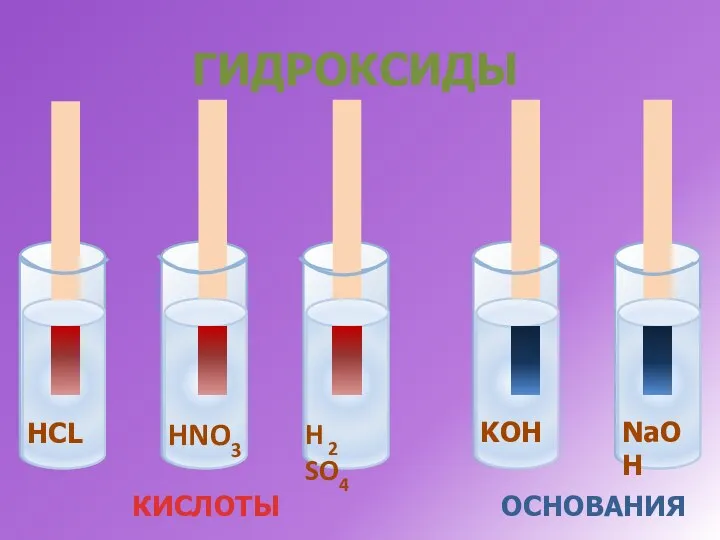
- 4. ГИДРОКСИДЫ КИСЛОТЫ ОСНОВАНИЯ HCL NaOH KOH H 2 SO4 HNO3
- 5. Приведите примеры ОСНОВАНИЙ
- 6. ПРИМЕРЫ ОСНОВАНИЙ: Na OH K OH Ca (OH)2 Ba (OH)2 Al (OH)3
- 7. Что общего в этих формулах? Гидроксильная группа -OH I и металлы
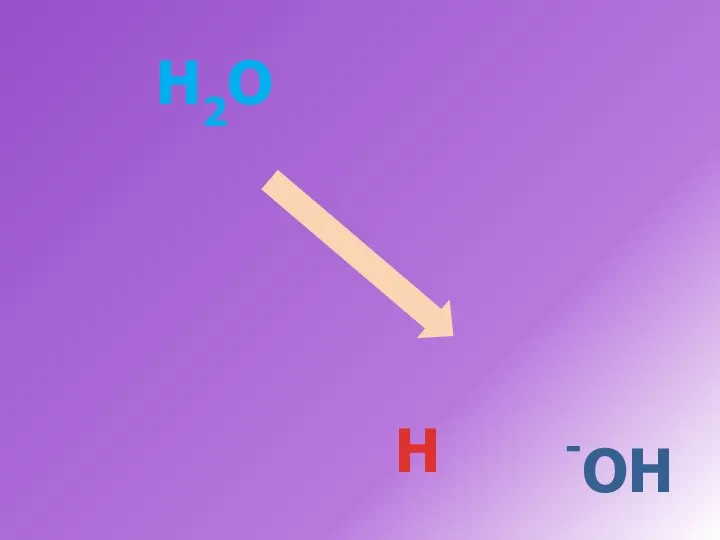
- 8. H2O H -OH
- 9. ОСНОВАНИЯ – ЭТО СЛОЖНЫЕ ВЕЩЕСТВА, В СОСТАВ КОТОРЫХ ВХОДЯТ АТОМЫ МЕТАЛЛОВ, СВЯЗАННЫЕ С ОДНОЙ ИЛИ НЕСКОЛЬКИМИ
- 10. Общая формула ОСНОВАНИЙ : (OH)n Me
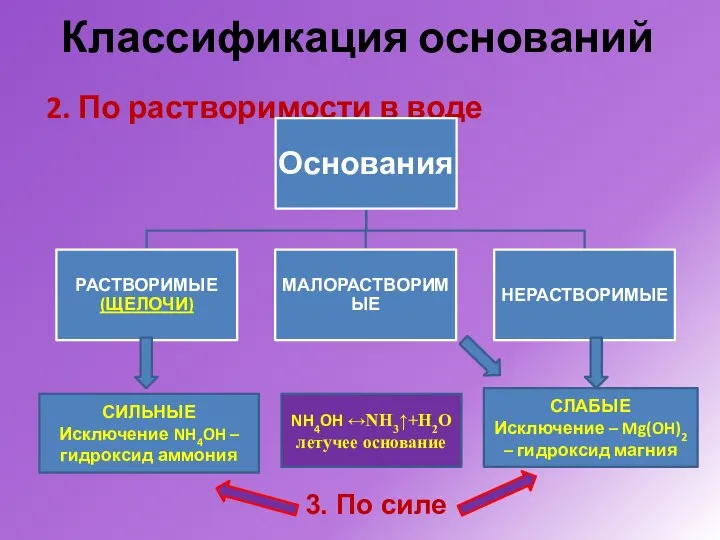
- 11. Как можно классифицировать ОСНОВАНИЯ ?
- 12. Классификация оснований 2. По растворимости в воде СЛАБЫЕ Исключение – Mg(OH)2 – гидроксид магния СИЛЬНЫЕ Исключение
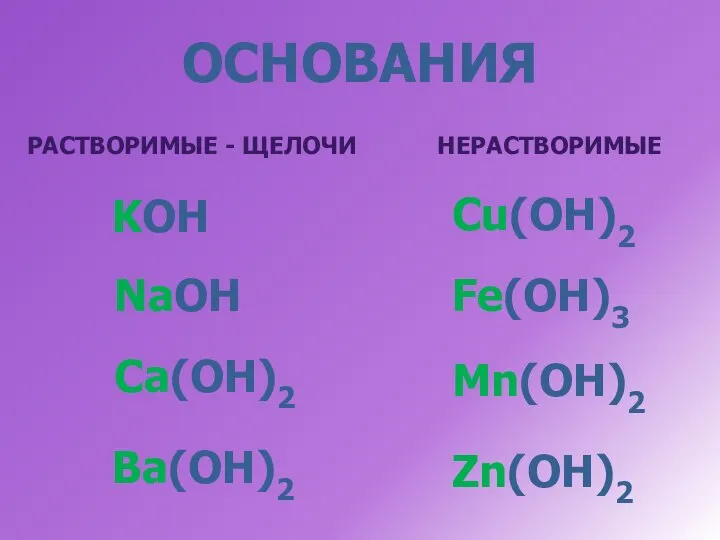
- 13. ОСНОВАНИЯ РАСТВОРИМЫЕ - ЩЕЛОЧИ НЕРАСТВОРИМЫЕ KOH NaOH Ca(OH)2 Ba(OH)2 Cu(OH)2 Fe(OH)3 Mn(OH)2 Zn(OH)2
- 14. Физические свойства ОСНОВАНИЙ
- 15. Твердое бесцветное вещество
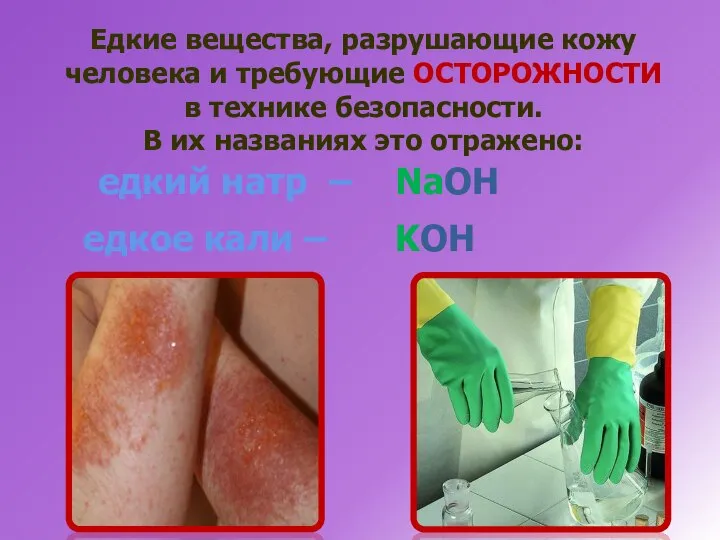
- 16. Едкие вещества, разрушающие кожу человека и требующие ОСТОРОЖНОСТИ в технике безопасности. В их названиях это отражено:
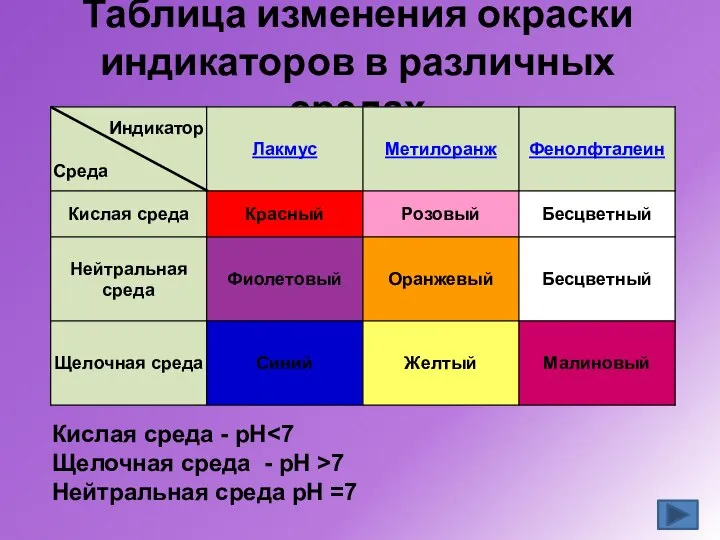
- 17. Таблица изменения окраски индикаторов в различных средах Кислая среда - рН Щелочная среда - рН >7
- 18. Химические свойства ЩЕЛОЧЕЙ: Взаимодействие с индикаторами. Взаимодействие с кислотами. + NaOH HCl = NaOH + HCl
- 19. РЕАКЦИЯ НЕЙТРАЛИЗАЦИИ – ЭТО ВЗАИМОДЕЙСТВИЕ МЕЖДУ КИСЛОТАМИ И ОСНОВАНИЯМИ С ОБРАЗОВАНИЕМ СОЛИ И ВОДЫ
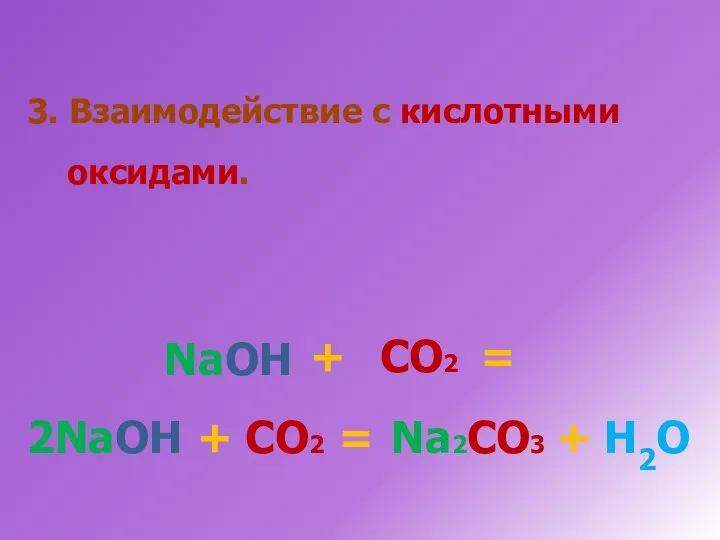
- 20. 3. Взаимодействие с кислотными оксидами. + NaOH СО2 = 2NaOH + СО2 = Na2CО3 + H2O
- 21. Качественное определение веществ Известковая вода – качественный реагент на углекислый газ Гидрокси́д ка́льция ( Ca(OH)2 ,
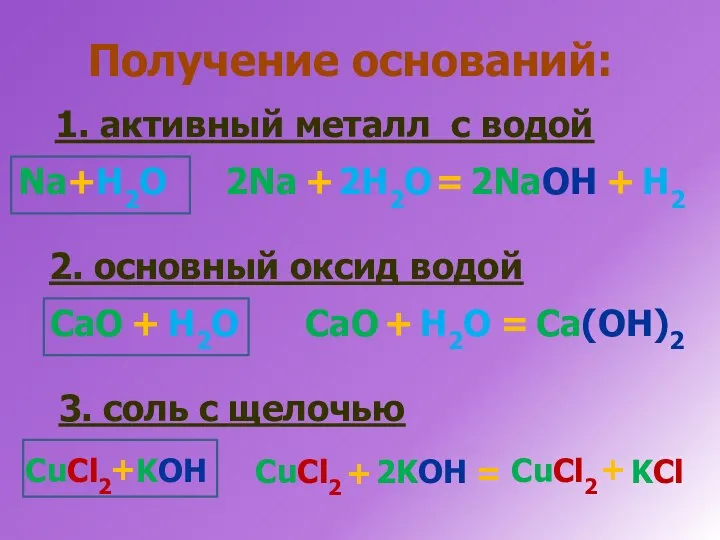
- 22. Получение оснований: 1. активный металл с водой Na + H2O 2Na + 2H2O = 2NaOH +
- 23. Едкий натр применяется во множестве отраслей промышленности и для бытовых нужд: в целлюлозно-бумажной промышленности для делигнификации
- 24. Гидроксид калия «калиевый щёлок» — KOH. Тривиальные названия: едкое кали, каустический поташ. Бесцветные, очень гигроскопичные кристаллы,
- 26. Скачать презентацию















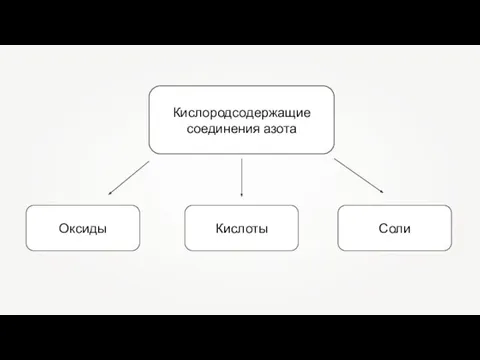 Кислородсодержащие соединения азота
Кислородсодержащие соединения азота Сложные эфиры
Сложные эфиры Nazwa peptydu. Sekwencja
Nazwa peptydu. Sekwencja Horenie
Horenie Практическая работа 1. ХТП. Классификация химических реакций
Практическая работа 1. ХТП. Классификация химических реакций Ацетиленовые углеводороды. Алкины
Ацетиленовые углеводороды. Алкины Знаки химических элементов. 8 класс
Знаки химических элементов. 8 класс Строение атома. Строение электронных оболочек атомов
Строение атома. Строение электронных оболочек атомов Хим-1 презент
Хим-1 презент Коррозия металлов
Коррозия металлов Геометрия молекул
Геометрия молекул Взаимодействие кислот с металлами. Кислоты-окислители
Взаимодействие кислот с металлами. Кислоты-окислители Алканы – строение, химические свойства
Алканы – строение, химические свойства Кабинет химии
Кабинет химии Основания. Определение. Формулы
Основания. Определение. Формулы Соли, их классификация и свойства
Соли, их классификация и свойства Презентация на тему Алкины
Презентация на тему Алкины  Сложные эфиры. Жиры
Сложные эфиры. Жиры Химия окислительновосстановительные реакции
Химия окислительновосстановительные реакции Химическая связь
Химическая связь Материалы в промышленности
Материалы в промышленности Графен. Нобелевская премия 2016
Графен. Нобелевская премия 2016 Химия в быту
Химия в быту Анализ катионов и анионов. Лекция № 2
Анализ катионов и анионов. Лекция № 2 Комплексные соединения
Комплексные соединения Типы химической связи
Типы химической связи Атомы химических элементов
Атомы химических элементов Получение и химические свойства металлов
Получение и химические свойства металлов