Содержание
- 2. №1. Электронная конфигурация 1s22s22p63s23p63d6 соответствует частице: 1) Fe+3 2) Fe+2 3) Fe0 4) Fe+6 № 2.
- 3. 1. Электронная конфигурация 1s22s22p63s23p63d6 соответствует частице: 1) Fe+3 2) Fe+2 3) Fe0 4) Fe+6 2. Для
- 4. № 4. При обычных условиях практически осуществима реакция между железом и: серой (крист.) серной кислотой (конц.)
- 5. №4 4) Fe + Cu(NO3)2= Fe(NO3)2 + Cu - идет при обычных условия: более активный металл
- 6. № 5. Вещество, при взаимодействии с которым железо окисляется до +3: 1)хлорид меди (II) 2)хлор 3)
- 7. Правильный ответ – 2
- 8. № 6. Сокращенное ионное уравнение Fе2+ + 2OH- → Fe(OH)2 соответствует взаимодействию веществ: 1) Fe(NO3)3 и
- 9. 6. Сокращенное ионное уравнение Fe2+ + 2OH- → Fe(OH)2 соответствует взаимодействию веществ: 1) Fe(NO3)3 +3 KOH
- 10. +NaOH +O2, H2O № 7. В схеме превращений: FeCl2 ----------→ X1 ---------→X2 веществом «Х2» является: оксид
- 11. Правильный ответ 2 FeCl2 + 2 NaOH = Fe(OH)2↓+2 NaCl 4Fe(OH)2+O2 + 2H2O = 4Fe(OH)3
- 12. № 8. В схеме превращений FeCl3 → X1 → X2 → Fe(OH)3 веществами «Х1» и «Х2»
- 13. Правильный ответ – 4 FeCl3 +3NaOH = Fe(OH)3↓ + 3NaCl 2Fe(OH)3↓ +3H2SO4 = Fe2 (SO4)3 +
- 14. № 9. Лакмус краснеет в растворе соли: 1) сульфат железа (II) 3) нитрат калия 2) хлорид
- 15. № 10. С помощью гидроксида натрия можно распознать раствор каждого и двух веществ: 1) нитрата железа
- 16. ОБНАРУЖЕНИЕ ИОНОВ ЖЕЛЕЗА Fe2+ + 2OH- → Fe(OH)2 зеленый осадок Fe3+ + 3OH- → Fe(OH)3 бурый
- 17. № 11. Верны ли следующие суждения о свойствах железа? А. Железо реагирует с разбавленной азотной кислотой.
- 18. Правильный ответ: 3) верны оба суждения
- 19. №12. Установите соответствие между реагирующими веществами и продуктами их взаимодействия: РЕАГИРУЮЩИЕ ПРОДУКТЫ ВЕЩЕСТВА ВЗАИМОДЕЙСТВИЯ А) Fe
- 20. Установите соответствие между реагирующими веществами и продуктами их взаимодействия: РЕАГИРУЮЩИЕ ПРОДУКТЫ ВЕЩЕСТВА ВЗАИМОДЕЙСТВИЯ А) Fe +
- 21. №13. Установите соответствие между формулой частицы и ее способностью проявлять окислительно-восстановительные свойства: А) Fe3+ 1) только
- 22. 00 Установите соответствие между формулой частицы и ее способностью проявлять окислительно-восстановительные свойства: А) Fe3+ 1) только
- 23. СХЕМА РЕАКЦИИ ИЗМЕНЕНИЕ СТЕПЕНИ ОКИСЛЕНИЯ ВОССТАНОВИТЕЛЯ А) Cu + 2FeCI3 ? CuCI2 +2FеCI2 1) 2I- ?
- 24. CХЕМА РЕАКЦИИ ИЗМЕНЕНИЕ СТЕПЕНИ ОКИСЛЕНИЯ ВОССТАНОВИТЕЛЯ А) Cu + 2FeCI3 ? CuCI2 +2FеCI2 2) Cu0 ?
- 25. № 15.Установите соответствие между названием соли и её отношением к гидролизу. НАЗВАНИЕ СОЛИ А) хлорид железа
- 26. №15. К 180,0 г 8%-ного раствора хлорида железа (II) добавили 20 г хлорида железа (II). Массовая
- 27. К 180,0 г 8%-ного раствора хлорида железа (II) добавили 20 г хлорида железа (II). Массовая доля
- 28. №16. Железо прокалили на воздухе. Полученное соединение, в котором металл находится в двух степенях окисления, растворили
- 29. 1) 3Fe + 2O2 = Fe3O4 2) 2Fe3O4 + 10H2SO4 = 3Fe2(SO4)3 + SO2 + 10H2O
- 30. № 17.Используя метод электронного баланса, составьте уравнение реакции: FeSO4 + K2SO4 + … + … --->
- 31. 6FeSO4 + K2SO4 + 7H2SO4 ---> 3Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + 7H2O
- 32. №18. Соль, полученную при растворении железа в горячей концентрированной серной кислоте, обработали избытком раствора гидроксида натрия.
- 33. 2Fe + 6H2SO4 =t= Fe2(SO4)3 + 3SO2 ↑ + 6H2O Fe2(SO4)3+6NaOH = 2Fe(OH)3↓+3Na2SO4 2Fe(OH)3↓=t=Fe2O3 +3 H2O
- 34. №19. Газ, выделившийся при взаимодействии хлористого водорода с перманганатом калия, реагирует с железом. Продукт реакции растворили
- 35. 1) 2KMnO4 + 16HCl =2 MnCl2+ 2KCl +5Cl2↑ +8H2O 2) 2Fe+3Cl2=2FeCl3 3) 2FeCl3+3Na2S+6H2O= 2Fe(OH)3↓ + 3H2S
- 36. №20. Зловонную жидкость, образовавшуюся при взаимодействии бромистого водорода с перманганатом калия, отделили и нагрели с железной
- 37. 1) 2KMnO4 + 16HBr =2 MnBr2+ 2KBr +5Br2↓ +8H2O 2) 2Fe+3Br2=2FeBr3 3) FeBr3+3CsOH=Fe(OH)3↓+3CsBr 4) 2Fe(OH)3= Fe2O3+3H2O
- 38. №21. Определите массовые доли(в%) сульфата железа(II) и сульфида алюминия в смеси, если при обработке25 г этой
- 39. Составлены уравнения реакций: Al2 S3 + 6H2 O= 2Al (OH)3 +3H2 S CuSO4 +H2 S =CuS
- 40. №22.В 50 мл. 15 %-ного раствора сульфата меди ( II ) (плотность раствора 1, 12 г/мл)
- 41. 20. mp(CuSO4)= ρ*V=50*1,12=56 г m(CuSO4)1= mp(CuSO4)1* ω (CuSO4)1 =56*0,15=8,4 г разность масс пластинки равна разности масс
- 43. Скачать презентацию








































 Характеристика химических элементов IV А группа. Углерод
Характеристика химических элементов IV А группа. Углерод Использование инновационных технологий в обучении химии как средство повышения подготовки специалистов
Использование инновационных технологий в обучении химии как средство повышения подготовки специалистов Сталь 12Х18Н10Т
Сталь 12Х18Н10Т Презентация на тему Полисахариды
Презентация на тему Полисахариды  Минералы
Минералы Первоначальные химические понятия
Первоначальные химические понятия Свойства бензола
Свойства бензола Презентация по Химии "Электрохимический ряд напряжений металлов. Общие химические свойства металлов"
Презентация по Химии "Электрохимический ряд напряжений металлов. Общие химические свойства металлов" 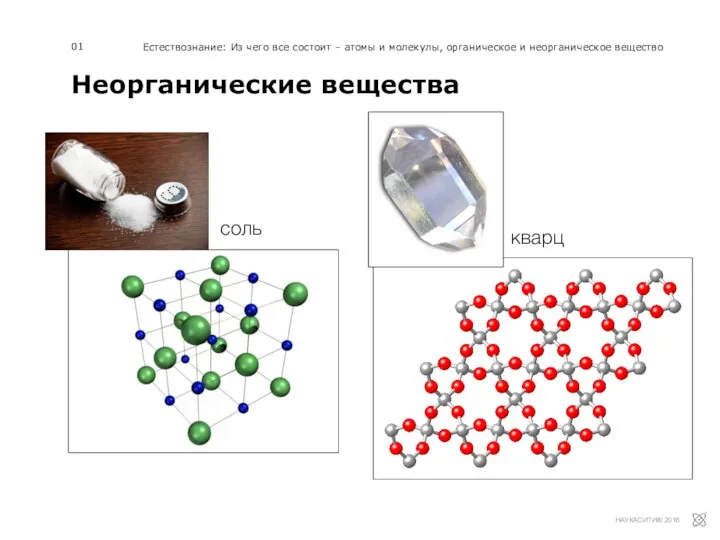 Неорганические вещества
Неорганические вещества Карбоновые кислоты
Карбоновые кислоты Природный газ
Природный газ Фосфор
Фосфор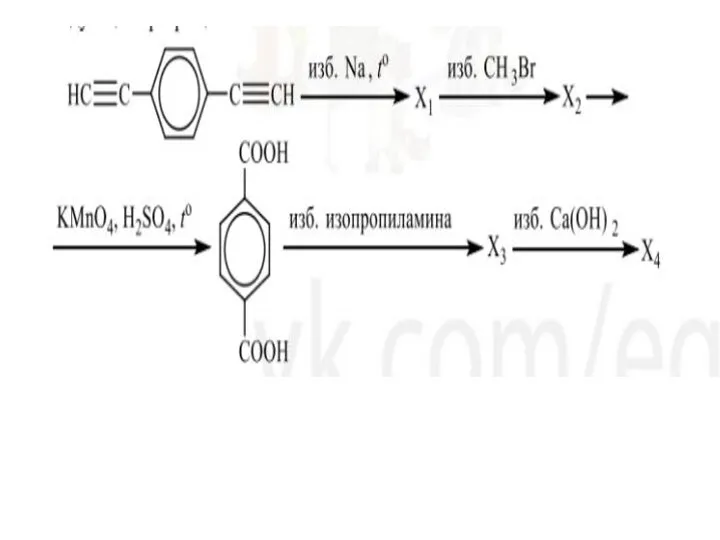 Арены
Арены Первоначальные сведения о строении вещества
Первоначальные сведения о строении вещества Классы неорганических веществ. Оксиды
Классы неорганических веществ. Оксиды Массообменные процессы
Массообменные процессы Способы получения металлов
Способы получения металлов Правила ТБ при работе в кабинете химии. Приёмы обращения с лабораторным оборудованием
Правила ТБ при работе в кабинете химии. Приёмы обращения с лабораторным оборудованием Удивительная соль
Удивительная соль Полиморфизм кристаллов изатина
Полиморфизм кристаллов изатина Нуклеирующие добавки
Нуклеирующие добавки Презентация на тему Гигиенические аспекты загрязнения пищевых продуктов чужеродными веществами
Презентация на тему Гигиенические аспекты загрязнения пищевых продуктов чужеродными веществами  Эмульсии
Эмульсии Дифференцированный подход в преподавании химии
Дифференцированный подход в преподавании химии Аппаратурное оформление процесса гидроочистки нефтяных фракций
Аппаратурное оформление процесса гидроочистки нефтяных фракций Презентация на тему Жидкое состояние вещества
Презентация на тему Жидкое состояние вещества  Свинец (plumbum)
Свинец (plumbum) Презентация на тему Кремний и его соединения
Презентация на тему Кремний и его соединения