Слайд 2Атомы галогенов на внешнем энергетическом уровне имеют семь электронов и до завершения
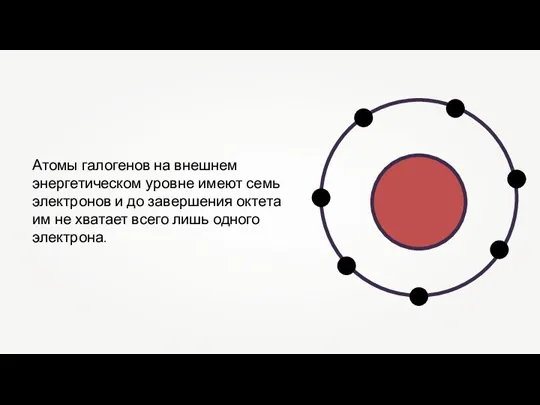
октета
им не хватает всего лишь одного электрона.
Слайд 3Галогены являются очень сильными окислителями. Фтор в химических реакциях проявляет только окислительные

свойства, и для него характерна степень окисления
-1 в соединениях. Все остальные галогены могут проявлять ещё и восстановительные свойства при взаимодействии с более электроотрицательными элементами, такими как кислород, азот, принимая значения степени окисления +1, +3, +5
или +7.
Слайд 7Химические свойства галогенов
Взаимодействие галогенов с металлами:
2Ag + F2 = 2AgF
2Fe + 3Cl2

= 2FeCl3
Cu + Br2 = CuBr2
2Al +3I2 = 2AlI3
Слайд 8Химические свойства галогенов
Взаимодействие галогенов с водородом:
Н2 + F2 = 2HF
H2 + Cl2

=2HCl
H2 + Br2 = 2HBr
H2 + I2 =2HI
Слайд 9Химические свойства галогенов
Взаимодействие галогенов со сложными веществами:
Cl2 + 2NaBr = 2NaCl +

Br2
Cl2 + 2KI = 2KCl + I2
2F2 + 2H2O = 4HF + O2
Слайд 10Анри Муассан
1852–1907 гг.
Французский химик. Впервые получил фтор в свободном виде в

1886 г., за что был удостоен Нобелевской премии. Название фторос, что в переводе с греческого значит «разрушающий», было дано из-за большой токсичности фтора.
Слайд 11Шведский химик. Открыл хлор
в 1774 г. Такое название хлор получил благодаря

цвету простого вещества, в переводе с греческого хлорос значит «жёлто-зелёный».
Слайд 12Французский химик. Открыл бром
в 1826 г. В переводе с греческого бромос

значит «зловонный», что
в действительности соответствует невыносимому запаху простого вещества брома.










 Кремний и его соединения
Кремний и его соединения Валентность. Определение валентности химических элементов по формуле вещества
Валентность. Определение валентности химических элементов по формуле вещества Способы очистки питьевой воды
Способы очистки питьевой воды Альдегиды. Общая формула
Альдегиды. Общая формула Валентность
Валентность Роль М.В Ломоносова и Дж.Дальтона в создании атомно-молекулярного учения.
Роль М.В Ломоносова и Дж.Дальтона в создании атомно-молекулярного учения. Экстракция
Экстракция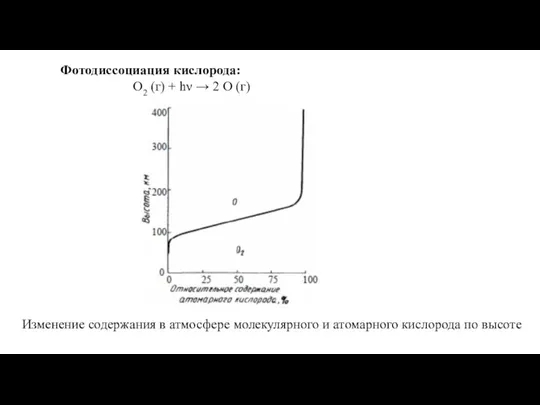 Фотодиссоциация кислорода
Фотодиссоциация кислорода Алкены-3
Алкены-3 Чему равно общее количество электронов в атоме?
Чему равно общее количество электронов в атоме? Сера и ее соединения
Сера и ее соединения Основные положения теории строения органических соединений А.М. Бутлерова
Основные положения теории строения органических соединений А.М. Бутлерова Химический тренажер
Химический тренажер Основы теории сплавов. Типы сплавов (твердые растворы, сплавы-смеси, сплавы- химические соединения. Диаграммы
Основы теории сплавов. Типы сплавов (твердые растворы, сплавы-смеси, сплавы- химические соединения. Диаграммы Презентация на тему СПИРТЫ (аканолы, алкоголи)
Презентация на тему СПИРТЫ (аканолы, алкоголи)  История развития химии
История развития химии Химические свойства металлов
Химические свойства металлов Порядок констант ССВ JHH в бензоле. Задачи
Порядок констант ССВ JHH в бензоле. Задачи Алкены. Непредельные углеводороды
Алкены. Непредельные углеводороды Chimie bioorganique
Chimie bioorganique Соли. Свойства. Получение
Соли. Свойства. Получение Самородные минералы
Самородные минералы Peek. Сферы применения
Peek. Сферы применения Структура неорганических ионных соединений. Лекция 12
Структура неорганических ионных соединений. Лекция 12 Показатели обогащения
Показатели обогащения Поливинилхлорид
Поливинилхлорид Получение и реакции пиразина
Получение и реакции пиразина Башня плотности
Башня плотности