Слайд 2
Открытый урок по теме :
Классификация неорганических веществ

Слайд 3Цель урока: обобщение и углубление изученного материала по классификации неорганических веществ, развитие

познавательной деятельности учащихся с помощью активных форм и методов обучения, позволяющие учащимся реализовать свои способности.
Форма урока: групповая по теме, индивидуальная , игровая.
Задачи урока: закрепить навыки и умения по применению теоретических знаний для решения и составления химических уравнений между веществами различных классов , решения расчетных задач.
Методы обучения: обучающий, познавательный, частично- поисковый с использованием информационных технологий.
Слайд 4Умения и навыки:
называть вещества по «тривиальной» и международной номенклатуре
классифицировать неорганические

вещества по составу и свойствам
характеризовать:
состав, свойства и применение основных классов неорганических соединений объяснять закономерности в изменении свойств веществ
распознавать важнейшие соединения
проводить вычисления по химическим формулам и уравнениям
составлять уравнения химических реакций
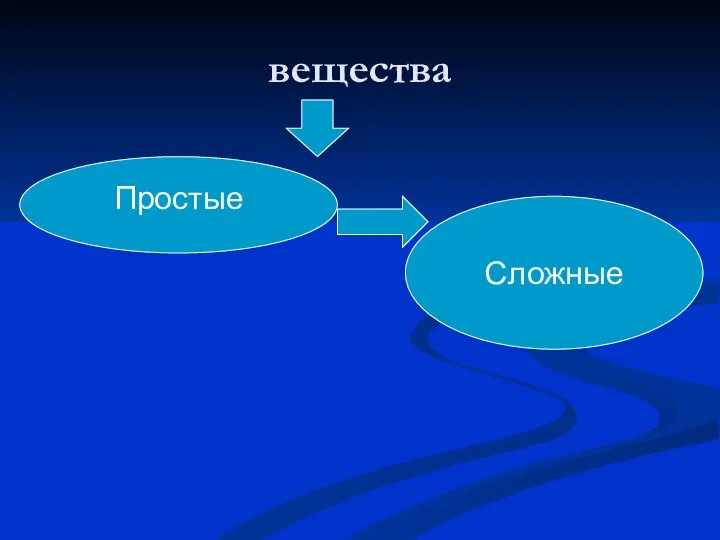
Слайд 5Классификация неорганических
веществ

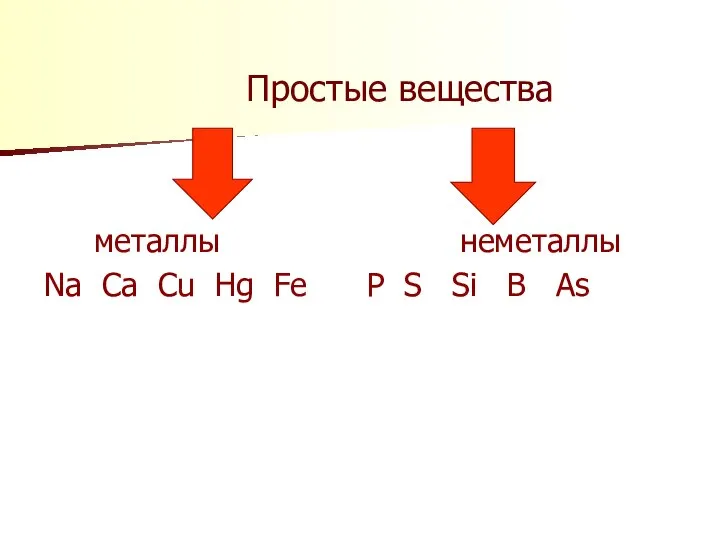
Слайд 7 Простые вещества
металлы неметаллы
Na Ca Cu Hg Fe P S Si
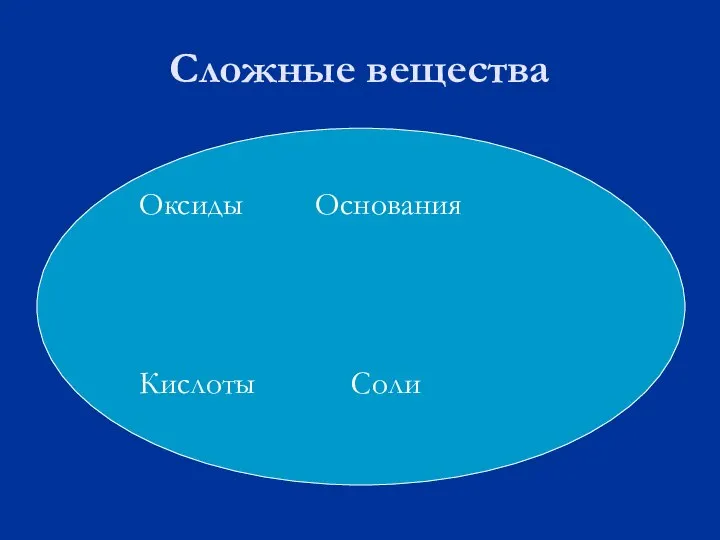
Слайд 8Сложные вещества
Оксиды Основания
Кислоты Соли
Слайд 9Примеры
Оксиды CaO MgO FeO ZnO
Кислоты HCl HNO3 H2SO4
Основания NaOH Ca(OH)2

Fe(OH)3
Соли KNO3 NaCl CuSO4
Слайд 10
Генетическая связь между различными классами веществ

Слайд 11 Металлы Переходный элемент Неметаллы
Основный Амфотерный Кислотный
оксид оксид
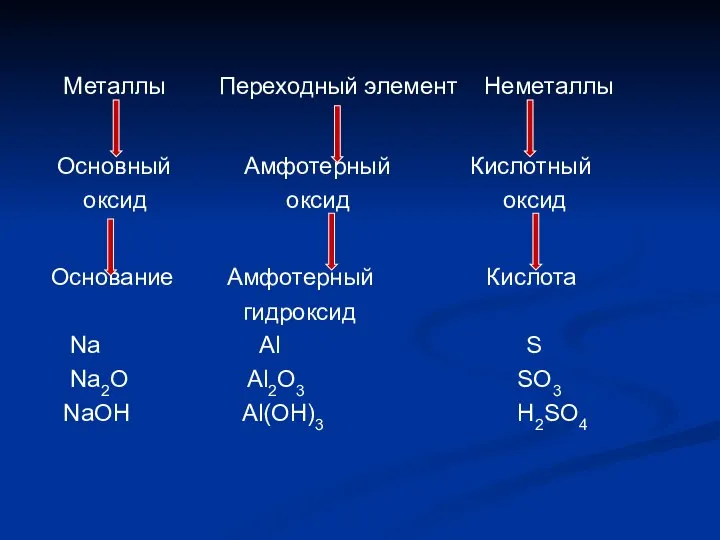
оксид
Основание Амфотерный Кислота
гидроксид
Na Al S
Na2O Al2O3 SO3
NaOH Al(OH)3 H2SO4
Слайд 12ЕГЭ по химии в 2012 году
Всего 43 задания. Часть 1 включает 28

заданий с выбором ответа базового уровня сложности.
Часть 2 включает 10 заданий с кратким ответом повышенного уровня сложности.
Часть 3 состоит из 5 заданий с развернутым ответом высокого уровня сложности.
Максимальный первичный балл составляет 65 баллов.
Тема «Классификация неорганических веществ» отражена в заданиях А7-А12, В5, С2, С3.2.
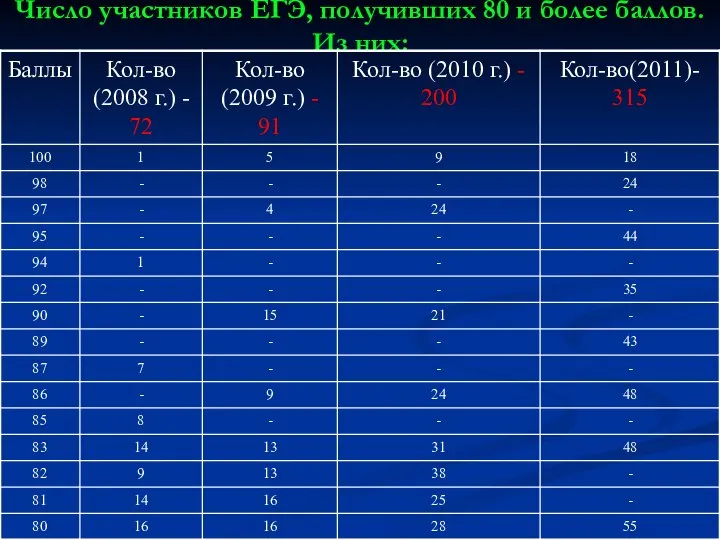
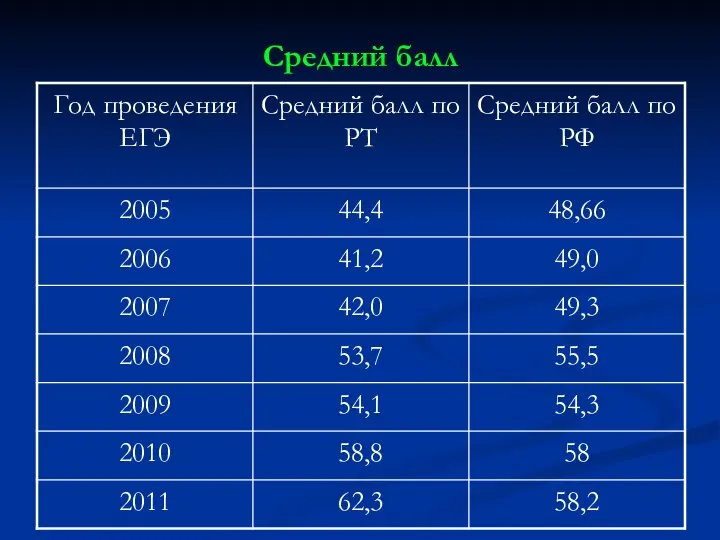
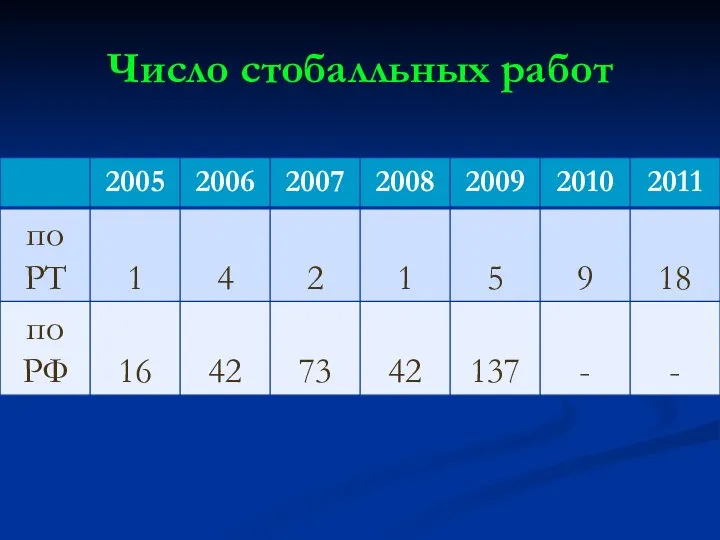
Слайд 14Число участников ЕГЭ, получивших 80 и более баллов. Из них:
Слайд 16
Средний балл учителей химии, имеющих категории по Республике Татарстан 80

баллов
Средний балл выпускников – 62,3
Слайд 17Задание с выбором ответа
1.Среди перечисленных веществ А) NaHCO3 Б) HCOOK B) (NH4)2SO4

Г) KHSO3
Д) Na2HPO4 Е) Na3PO4
кислыми солями являются
1) АГД 2) АВЕ 3) БДЕ 4) ВДЕ
2.Какой оксид реагирует с раствором НСl, но не реагирует с раствором NaOH ?
1) CO 2) SO3 3) P2O5 4) MgO
Слайд 18Задание с кратким ответом
С какими веществами могут реагировать оксиды?
А)оксид калия Б)оксид углерода

В)оксид хрома(lll)
Г)оксид фосфора(V)
1) H2O, MgO, LiOH
2) Fe3O4, H2O, Si
3) H2, Fe3O4, O2
4) H2O, N2O3, H3PO4
5) H2SO4, NaOH, Al
6) Al, N2O3, H2O
Слайд 19Ответы на задания
Задания с выбором ответа
1. 1) 2. 4)
Задание с кратким ответом
4

3 5 1
Слайд 20Задание с развернутым ответом
Соль, полученную при растворении железа в горячей концентрированной

серной кислоте, обработали избытком раствора гидроксида натрия. Выпавший бурый осадок отфильтровали и прокалили. Полученное вещество сплавили с железом.
Напишите уравнения описанных реакций.
Слайд 21Ответ:
2Fe + 6H2SO4 = Fe2(SO4)3 + 3SO2 + 6H2O
Fe2(SO4)3 + 6NaOH

= 2Fe(OH)3 + 3Na2SO4
2Fe(OH)3 = Fe2O3 + 3H2O
Fe2O3 + Fe = 3FeO
Слайд 231. Проделать реакцию между оксидом меди(II) и серной кислотой.
2. Проделать реакцию между

азотной кислотой и гидроксидом натрия.
3. Записать уравнения проделанных реакций.
Слайд 25Задание на дом:
Соль, полученную при растворении алюминия в сильноразбавленной азотной кислоте,

прокалили. Полученный твердый остаток растворили в концентрированном растворе гидроксида калия. При пропускании сероводорода через полученный раствор образовался осадок.
Напишите уравнения описанных реакций.
Слайд 26Ответ:
8Al + 30HNO3 = 8Al(NO3)3 + 3NH4NO3 + 9H2O
4Al(NO3)3 = 2Al2O3 +

12NO2 + 3O2
Al2O3+ 6KOH +3H2O = 2K3[Al(OH)6]
K3[Al(OH)6] + 3H2S = 3KHS + Al(OH)3 + 3H2O






















 Моноенаминирование 4-пиронов и 4-метилен-4н-пиранов
Моноенаминирование 4-пиронов и 4-метилен-4н-пиранов Важнейшие классы неорганических соединений
Важнейшие классы неорганических соединений Электролиз расплавов и растворов электролитов
Электролиз расплавов и растворов электролитов Минеральные компоненты молока и молочных продуктов. Макроэлементы
Минеральные компоненты молока и молочных продуктов. Макроэлементы Алгоритм решения задач по химии.
Алгоритм решения задач по химии. Zirconium Dioxide
Zirconium Dioxide Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Аммиак
Аммиак Интеллектуальная игра по теме: «Периодический закон и система химических элементов Д.И. Менделеева». «Химический дом и его обитат
Интеллектуальная игра по теме: «Периодический закон и система химических элементов Д.И. Менделеева». «Химический дом и его обитат Общая характеристика оксидов
Общая характеристика оксидов Ортофосфорная кислота
Ортофосфорная кислота Вдоль по радуге
Вдоль по радуге Химия дома
Химия дома 01_Khimicheskiy_sostav
01_Khimicheskiy_sostav Молекулярная химия
Молекулярная химия Фосфор. Урок в 9 классе
Фосфор. Урок в 9 классе Создание из таблицы Менделеева и растворимости мини-справочник - шпаргалку
Создание из таблицы Менделеева и растворимости мини-справочник - шпаргалку Предельные одноатомные спирты
Предельные одноатомные спирты Химические средства защиты растений. Последствия применения пестицидов
Химические средства защиты растений. Последствия применения пестицидов Методические рекомендации по преподаванию учебного предмета Химия в 2021-2022 учебном году
Методические рекомендации по преподаванию учебного предмета Химия в 2021-2022 учебном году Элемент Фосфор
Элемент Фосфор Кислород – это самый распространенный на нашей планете элемент
Кислород – это самый распространенный на нашей планете элемент Игровые технологии на уроках химии как средство реализации системно-деятельного подхода в обучении
Игровые технологии на уроках химии как средство реализации системно-деятельного подхода в обучении Основы общей химии
Основы общей химии Щелочные металлы
Щелочные металлы Ковалентная связь
Ковалентная связь Презентация по Химии "Ароматы и чем они «пахнут»"
Презентация по Химии "Ароматы и чем они «пахнут»"  Металл XXI века титан
Металл XXI века титан