Слайд 2Содержание:
Что такое мыло?
Как получают мыло?
Омыление.
Хозяйственное мыло.
Туалетное мыло.
Моющее действие мыла.
Недостатки мыла.
Синтетические моющие средства.
Получение

СМС.
Состав СМС.
ДЛЯ ЧЕГО НУЖНЫ СОСТАВНЫЕ ЧАСТИ СМС.
Влияет ли температура на моющее действие СМС.
Вывод:
Используемая литература.
Слайд 3Мыла – это натриевые или калиевые соли высших карбоновых кислот: пальмитиновой, стеариновой,

олеиновой, лауриновой.
Что такое мыло?
Слайд 4Как получают мыло?
Жир
парафин
омыление
Жир
парафин
Высаливание
с NaCl
Высаливание
с NaCl
Высаливание
с NaCl
Дополнительная
обработка
Дополнительная
обработка
формование
охлаждение
Твердые сорта получают, высушивая

ленту расплавленного мыла, добавляя красители и отдушки и прессуя готовую массу в куски.
Слайд 5Омыление.
В результате омыления образуется ядровое мыло из которого изготавливают хозяйственное и туалетное

мыло.
С3Н5(С13Н35СОО)3+3NaOH 3C17H35 COONa+C3H5(OH)3
2С15Н31СООН+Na2СО3 2С15Н31СООNa+Н2О+СО2
Слайд 6Хозяйственное мыло.
Твердые хозяйственные мыла в зависимости от сорта содержат 40-72% основного

вещества, 0,1-0,2% свободной щелочи, 1-2% свободных карбонатов Na или К, 0,5-1,5% нерастворимого в воде остатка
Слайд 7Туалетное мыло.
Получают путем дополнительной обработки ядрового мыла с добавлением: красителей, антисептиков,

талька, соды, каолина, душистых веществ.
Слайд 8Моющее действие мыла.
Молекулы мыла прикрепляются к мицоле(грязный жир) и удаляет ее.

Слайд 9Недостатки мыла.
Не отстирывает в жесткой воде.
Мало пенится.

Слайд 10Синтетические моющие средства.
Синтетические моющие средства - это натриевые соли кислых сложных

эфиров высших спиртов и серной кислоты.
Слайд 11Получение СМС.
R-CH2-OH + H-O-SO2-OH=R-CH2-O-SO2-OH + H2O
R-CH2-O-SO2-OH + NaOH=R-CH2-O-SO2-ONa + H2O

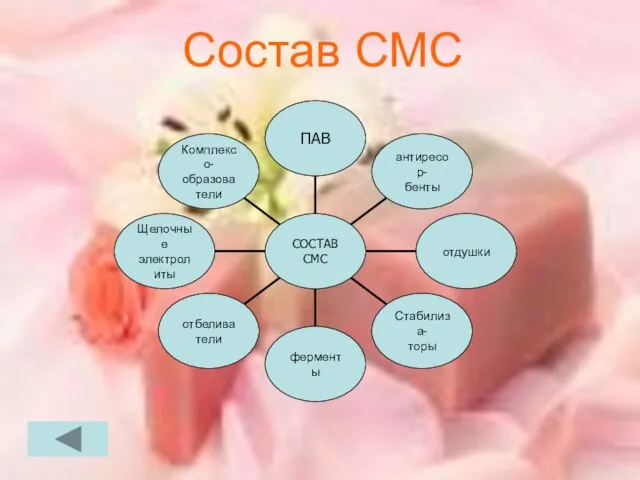
Слайд 13ДЛЯ ЧЕГО НУЖНЫ СОСТАВНЫЕ ЧАСТИ СМС.
Катионоактивные ПАВ-обладает, кромеиоющего, еще и дезинфицирующим действием.

Неионогенные ПАВ образуют сравнительно мало пены, и на их основе готовят средства для машинной стирки.
2. Комплексообразователи(Триполифосфат натрия)-одно из немногих хорошее растворимых в воде соединений фосфорной кислоты)
Взаимодействуя с находящимися в воде ионами кальция и магния, фосфат-ион переводит их в осадок состава Са3(РО4)2 и Mg3(РО4)2
Слайд 143. Щелочное отбеливание(процесс гидролиза)-это реакция обменного разложения веществ водой.
Рассмотрим подробнее гидролиз слабой

кислоты-Na2CO3 –карбонат натрия.
NaОН Na2CO3 Н2CO3
Сильное однокислотное основание слабая двухосновная кислота
Гидролиз соли происходит по аниону CO3 .
2Na + CO3 + Н2О НCO3 + 2Na + ОН
Продукт гидролиза - NaН CO3 и NaОН.
Среда водного раствора Na -Na2CO3CO3 –щелочная (рН >7),потому что в растворе увеличивается концентрация ионов ОН.
Гидролиз по аниону соли гидролизуется обратимо.
Химическое равновесие в таких реакциях сильно смещается влево;
При гидролизе солей, образованных слабыми многоосновными кислотами, получаются кислые соли.
Гидролиз зависит от температуры: при нагревании раствора усиливается гидролиз, усиливается эндотермическая диссоциация воды:
Н2О Н + ОН - 57 кДж, значит, увеличивается количество ионов Н и ОН .
Чтобы подавить гидролиз, нужно охладить раствор.
Слайд 154.отбеливатели-для удаления цветных загрязнений, оставщихся после стирки, и отбеливания.
5.отдушки-впринципе не имеет отношение

к стирке, а просто придает белью приятный запах.
6. стабилизаторы(Карбоксиметилцелюллоза (КМЦ)) выполняет роль стабилизатора пены.
Слайд 16Влияет ли температура на моющее действие СМС.
Сделав раствор порошка , разделить раствор

на 4 части.
В первую часть раствора добавить несколько капель фенолфталеина. Он дает порошку малиновый цвет и показывает щелочную среду. При нагревании цвет раствора усиливается.
Во вторую часть добавить лакмус. Он дает раствору синий цвет и выявляет щелочную среду. При нагревание так же усиливается цвет.
В третью часть раствора порошка добавляем метил оранжевый. Он дает раствору оранжевый оттенок и выявляет щелочную среду.
В четвертую часть порошкового раствора при t=20Co опустить РН-полоску (полоска показала РН=10;это значит, что уже в холодной воде щелочная среда высокая). Далее подогреть раствор t=60CO и так же опустить РН-полоску (РН=12;это максимально высокая щелочная среда).
Отсюда , чем выше to , тем сильнее выражена щелочность раствора. Поэтому не желательно стирать вещи из деликатных и синтетических тканей в горячей воде, так как гидролиз с повышением температуры происходит сильнее и это может привести к разрушению волокон ткани.
Слайд 17Вывод:
Вообще говоря, для стирки можно использовать разные средства: в каких-то случаях

подойдет и мыло, и сода, и стиральный порошок (а в полном отрыве от цивилизации можно попробовать стирку с древесной золой, которая , как известно, подщелачивает воду). Главное, чтобы выбранное моющее средство более или менее успешно выполняло две функции:
* удаление частиц грязи с очищаемой поверхности и
* перенос их в раствор.















 Производство аммиака
Производство аммиака кристаллические решетки (2) (2)
кристаллические решетки (2) (2) Работа по химии и информатике Селезневой Алены
Работа по химии и информатике Селезневой Алены Непредельные углеводороды
Непредельные углеводороды Презентация по Химии "Металлы в организме человека"
Презентация по Химии "Металлы в организме человека"  Презентация на тему Соединения химических элементов
Презентация на тему Соединения химических элементов  Углеводороды
Углеводороды Клеящие материалы
Клеящие материалы Эффект растворителя при определении пространственной структуры сложных гетероциклических соединений
Эффект растворителя при определении пространственной структуры сложных гетероциклических соединений Алканы
Алканы Классификация реагентов и реакции в органической химии
Классификация реагентов и реакции в органической химии Физико-математические основы химии: Количество вещества, Молярная масса, Молярный объём, Число Авогадро
Физико-математические основы химии: Количество вещества, Молярная масса, Молярный объём, Число Авогадро Закон сохранения массы и химические уравнения
Закон сохранения массы и химические уравнения Кислоты. Классификация кислот
Кислоты. Классификация кислот Липиды
Липиды Заманауи косметика биотехнологиясы
Заманауи косметика биотехнологиясы Кристаллы
Кристаллы Реакция Фриделя-Крафтса
Реакция Фриделя-Крафтса Сравнительный анализ Фармакопейных статей для субстанций, представленных в мировых Фармакопеях
Сравнительный анализ Фармакопейных статей для субстанций, представленных в мировых Фармакопеях Лабораторно-практическое занятие № 5. Неметаллические материалы
Лабораторно-практическое занятие № 5. Неметаллические материалы Структура к свойства веществ
Структура к свойства веществ Соединения галогенов
Соединения галогенов Арены. Бензол
Арены. Бензол Сталь. Химический состав стали
Сталь. Химический состав стали Туф вулканический
Туф вулканический Адиабатическое приближение, потенциальные поверхности молекулярных систем, неадиабатические переходы
Адиабатическое приближение, потенциальные поверхности молекулярных систем, неадиабатические переходы Типы химических реакций в органической химии
Типы химических реакций в органической химии Положение об осуществлении контроля за внешнеэкономической деятельностью в отношении химикатов, оборудования и технологий
Положение об осуществлении контроля за внешнеэкономической деятельностью в отношении химикатов, оборудования и технологий