Содержание
- 2. Уровни сложности задания: Б – базовый - 68% П – повышенный - 18% В – высокий
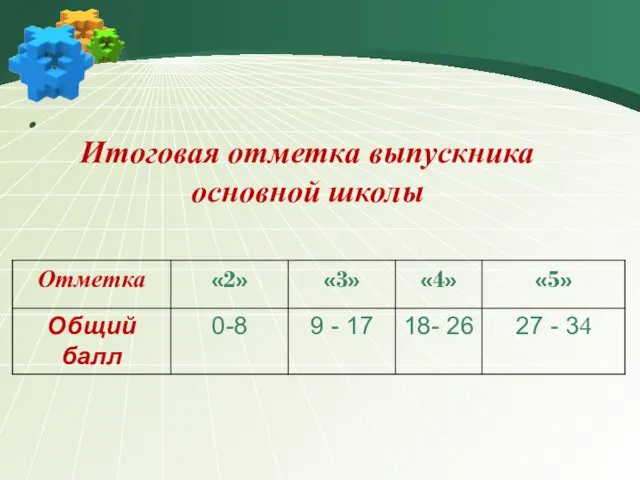
- 3. . Итоговая отметка выпускника основной школы
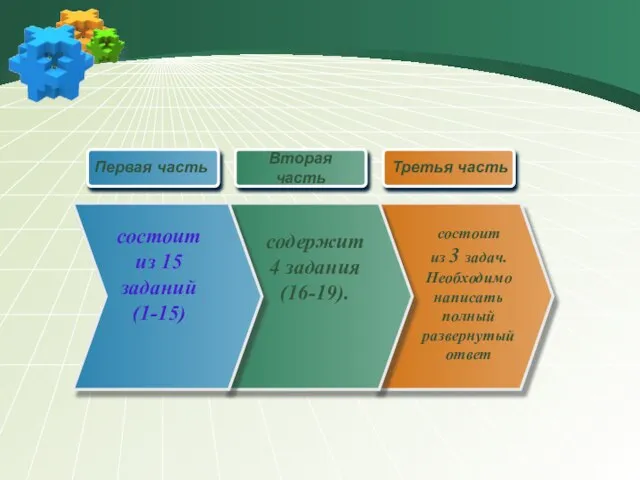
- 4. СТРУКТУРА ГИА
- 5. СОДЕРЖАТЕЛЬНЫЕ БЛОКИ (ТЕМЫ, РАЗДЕЛЫ)
- 6. Время проведения экзамена 120 минут (2 часа). Разрешенные материалы периодическая система химических элементов Д.И. Менделеева таблица
- 7. состоит из 15 заданий (1-15) Первая часть содержит 4 задания (16-19). состоит из 3 задач. Необходимо
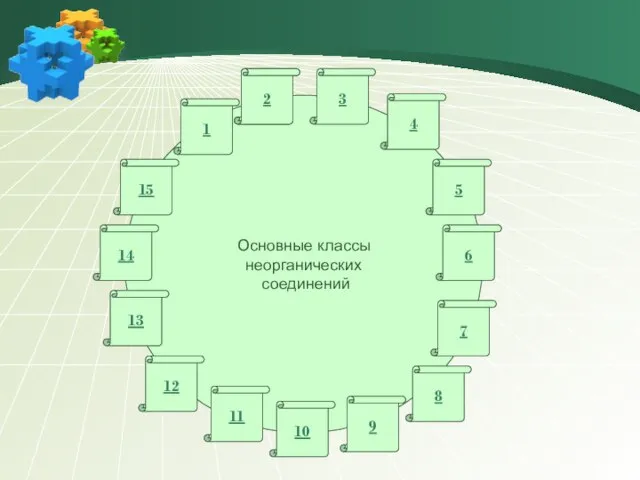
- 8. Основные классы неорганических соединений 1 6 7 8 9 10 11 12 13 14 15 2
- 9. 1 Общее число электронов в атоме бериллия равно 1) 6 2) 4 3) 3 4) 5
- 10. 2 B pяду N – P – As - Sb 1) увеличивается число энергетических уровней в
- 11. 3 В соединении натрия с серой химическая связь 1) ковалентная неполярная 2) ковалентная полярная 3) ионная
- 12. 4 Наибольшая степень окисления азота в соединении 1) HNO3 2) Na3N 3) N2O 4) N2H4 В
- 13. 5 К основным оксидам относится 1) NO 2) К2О 3) Fe2O3 4) СО Вещества, формулы которых
- 14. 6 Масса всех веществ, участвующих в химической реакции 1) увеличивается 2) уменьшается 3) не изменяется 4)
- 15. 7 Наименьшее число ионов образуется в разбавленном растворе при полной диссоциации 1 моль FeCl3 2) Na2S
- 16. 8 Газ выделяется при взаимодействии 1) MgCl2 и Ba(NO3)2 2) Na2CO3 и CaCl2 3) NH4Cl и
- 17. 9 И литий, и железо при комнатной температуре реагируют с 1) гидроксидом натрия 2) водой 3)
- 18. 10 Оксид цинка реагирует с каждым веществом пары 1) Na2O и H2O 2) SiO2 и Ag
- 19. 11 Железо взаимодействуете каждым из двух веществ: 1) оксид углерода (IV), водород 2) соляная кислота, кислород
- 20. 12 Среди веществ: NaCl, Na2S, Na2SO4 – в реакцию с раствором Cu(NO3)2 вступает(-ют) 1) только Na2S
- 21. 13 Верны ли суждения о химическом загрязнении окружающей среды и его последствиях? А. Повышенное содержание в
- 22. 14 Степень окисления химических элементов. Окислитель и восстановитель. Окислительно-восстановительные реакции 1. К окислительно-восстановительным реакциям относятся 1)
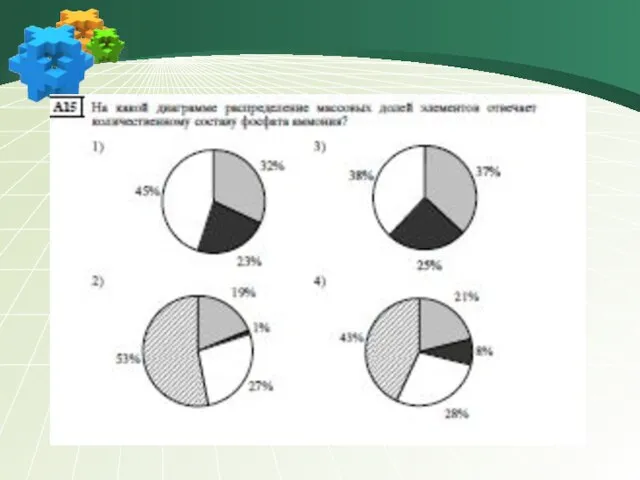
- 23. 15 Массовая доля азота в нитрате алюминия равна 1) 19,7% 2) 27,2% 3) 36,8% 4) 54,9%
- 25. Периодический закон Д.И. Менделеева Закономерности изменения свойств элементов и их соединений в связи с положением в
- 26. 16 В каких рядах химические элементы расположены в порядке уменьшения кислотных свойств их высших оксидов? 1)
- 27. Первоначальные сведения об органических веществах 17 Углеводороды предельные и непредельные: метан, этан, этилен, ацетилен Кислородсодержащие вещества:
- 28. Первоначальные сведения об органических веществах Для этанола верны следующие утверждения: 1) в состав молекулы входит один
- 29. 18 Определение характера среды раствора кислот и щелочей с помощью индикаторов. Качественные реакции на ионы в
- 30. 14 В приборе, изображённом на рисунке, получают 1) хлор 2) аммиак 3) кислород 4) хлороводород Получение
- 31. Группы газов газы – простые вещества N2, O2, H2, Cl2 2) газы – оксиды CO, CO2,
- 32. Физические свойства газов Водород - Н2– самый легкий, бесцветный, не имеет запаха. Кислород - О2 -
- 33. Получение какого газа показано на рисунке? А) аммиак Б) кислород В) углекислый газ Г) водород
- 34. Идентификация газов О2 Поддерживает горение – тлеющая лучинка в нем вспыхивает Н2 Горючий газ. Набранный в
- 35. Определение какого газа показано на рисунке? А) аммиак Б) кислород В) углекислый газ Г) сероводород
- 36. Установите соответствие между двумя веществами и реактивом, с помощью которого эти вещества можно различить. 18
- 37. 19 Химические свойства простых веществ. Химические свойства сложных веществ.
- 38. Установите соответствие между названием вещества и реагентами, с которыми это вещество может взаимодействовать. НАЗВАНИЕ ВЕЩЕСТВА РЕАГЕНТЫ
- 39. 20 Степень окисления химических элементов. Окислитель и восстановитель. Окислительно-восстановительные реакции
- 40. Установите соответствие между схемой химической реакции и веществом - восстановителем в ней. СХЕМА РЕАКЦИИ ВОССТАНОВИТЕЛЬ А)
- 41. 21
- 42. 22 170 г раствора нитрата серебра смешали с избытком раствора хлорида натрия. Выпал осадок массой 8,61
- 43. С3 22 Химические свойства простых веществ. Химические свойства сложных веществ. Взаимосвязь различных классов неорганических веществ. Реакции
- 44. С3 Для определения качественного состава неизвестной соли учащимся выдали белое кристаллическое вещество, хорошо растворимое в воде
- 45. На занятиях химического кружка учащиеся исследовали кристаллическое вещество белого цвета. В результате добавления к нему гидроксида
- 46. 22
- 48. Скачать презентацию









































 Лекция 6 Смазочные масла
Лекция 6 Смазочные масла Презентация на тему Моющие средства
Презентация на тему Моющие средства  Презентация на тему Соединения химических элементов
Презентация на тему Соединения химических элементов  Способы разделения нефти. Ректификация
Способы разделения нефти. Ректификация Активизация познавательной деятельности на уроках химии при работе с МГП (малыми графическими пособиями)
Активизация познавательной деятельности на уроках химии при работе с МГП (малыми графическими пособиями) Лекция 3. Строение электронной оболочки атома (1)
Лекция 3. Строение электронной оболочки атома (1) Презентация на тему Химические вещества: строительные и поделочные материалы
Презентация на тему Химические вещества: строительные и поделочные материалы  Реакции по направлению процесса
Реакции по направлению процесса Современная ВЭЖХ. Круг анализируемых объектов. Сорбенты и подвижные фазы для ВЭЖХ. (Лекция 2)
Современная ВЭЖХ. Круг анализируемых объектов. Сорбенты и подвижные фазы для ВЭЖХ. (Лекция 2) Конкурс юных химиков
Конкурс юных химиков Химические уравнения
Химические уравнения Металлы. Общая характеристика, химические свойства. Получение
Металлы. Общая характеристика, химические свойства. Получение Кислород и озон
Кислород и озон Урок №10 12 класс
Урок №10 12 класс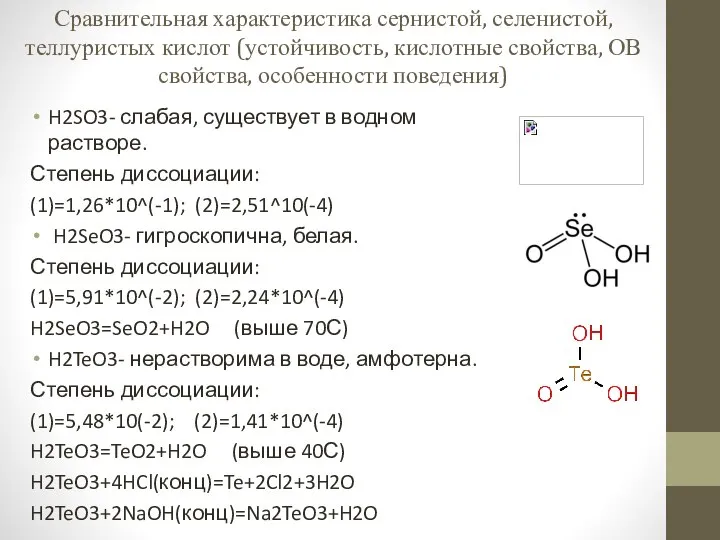 Сравнительная характеристика сернистой, селенистой, теллуристых кислот
Сравнительная характеристика сернистой, селенистой, теллуристых кислот Заполни электронные уровни элементов
Заполни электронные уровни элементов Углеводороды: изомерия
Углеводороды: изомерия Олово
Олово Альдегиды и кетоны
Альдегиды и кетоны Вычислительные методы в химии. Что такое вычислительная (компьютерная) химия. Лекция 1
Вычислительные методы в химии. Что такое вычислительная (компьютерная) химия. Лекция 1 Различные типы неорганических полимеров
Различные типы неорганических полимеров Водород. Вода
Водород. Вода Аналитическая химия (ЛЕКЦИЯ 1)
Аналитическая химия (ЛЕКЦИЯ 1) Периодический закон и периодическая система элементов Д.И. Менделеева
Периодический закон и периодическая система элементов Д.И. Менделеева Растворы. Лекция 7
Растворы. Лекция 7 Биоорганическая химия
Биоорганическая химия Производные углеводородов
Производные углеводородов Алкены
Алкены