Содержание
- 2. План изучения темы: Состав, названия и определение оснований. Классификация оснований. Физические свойства оснований. Химические свойства оснований.
- 3. Основания – это сложные вещества, состоящие из атома металла и одной или нескольких гидроксогрупп.
- 4. Состав оснований: Назовите составные части оснований. Ме(ОН)х Валентность гидроксогруппы (ОН) – I Количество гидроксогрупп определяется валентностью
- 5. Выберите формулы оснований. Назовите их. НСl, NaOH, Na2O, Ca(OH)2, H2SO4, P2O5, Fe(OH)3, MgO, Cи(OH)2
- 6. Основания NaOH – гидроксид натрия Ca(OH)2 – гидроксид кальция Fe(OH)3 – гидроксид железа (III) Cи(OH)2 –
- 7. Основания раздел Классификаций
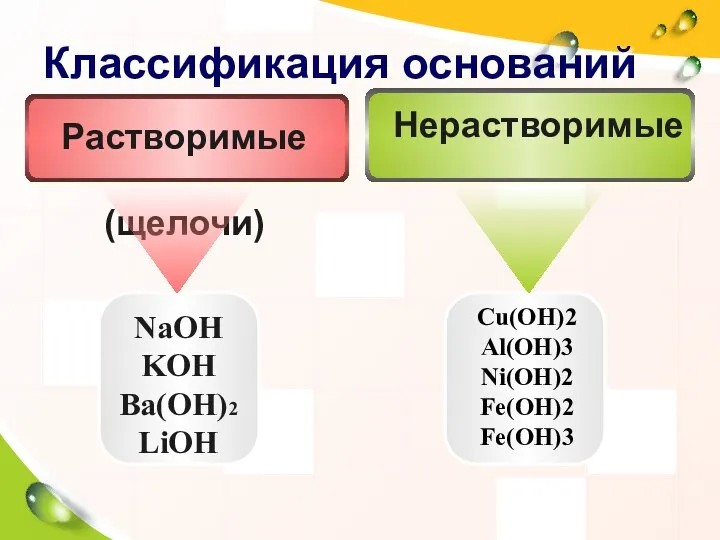
- 8. Классификация оснований NaOH KOH Ba(OH)2 LiOH Cu(OH)2 Al(OH)3 Ni(OH)2 Fe(OH)2 Fe(OH)3 Нерастворимые Растворимые (щелочи)
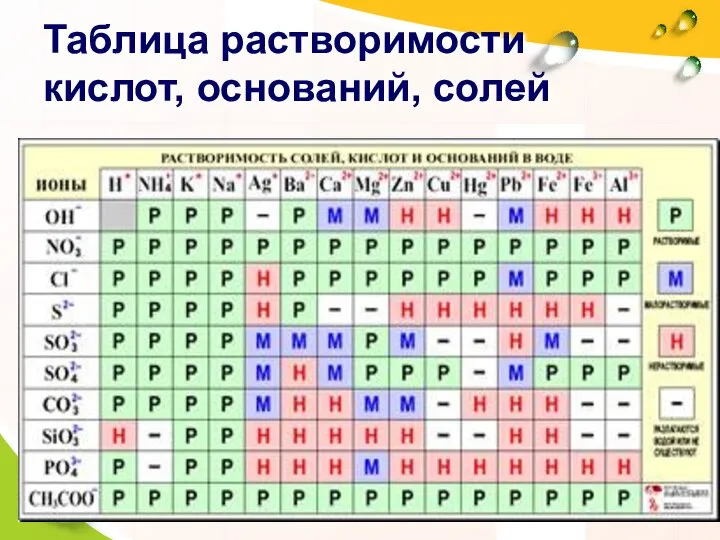
- 9. Таблица растворимости кислот, оснований, солей
- 11. По какому признаку основания разделены на группы? NaOH KOH LiOH СsOH Cu(OH)2 Ba(OH)2 Pb(OH)2 Fe(OH)2 Al(OH)3
- 12. Однокислотные NaOH, KOH Двухкислотные Pb(OH)2, Fe(OH)2 Трехкислотные Al(OH)3 Классификация оснований по числу гидроксогрупп. Основания
- 13. Основания раздел Физический (свойства)
- 14. Физические свойства оснований Агрегатное состояние: Все твердые вещества Цвет кислот: Белого – КОН, Голубого - Cu(OH)2
- 15. Основания раздел Химический (свойства)
- 16. Химические свойства нерастворимых оснований. 1). Разлагаются при нагревании. 2). Взаимодействуют с кислотами (реакция нейтрализации).
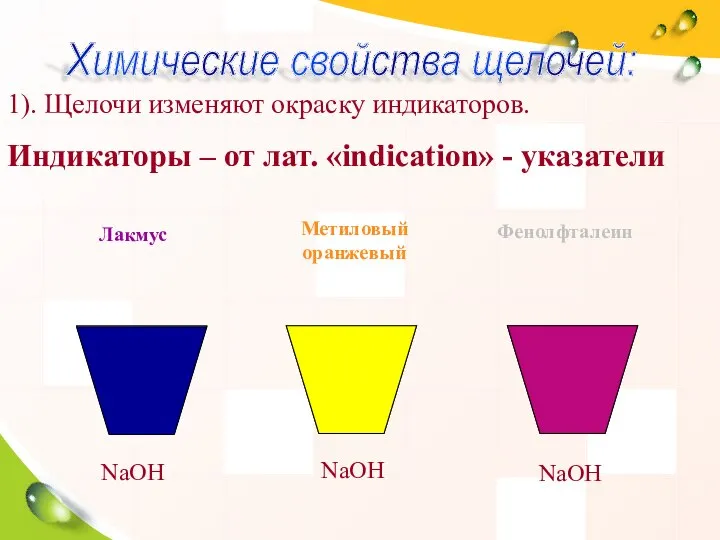
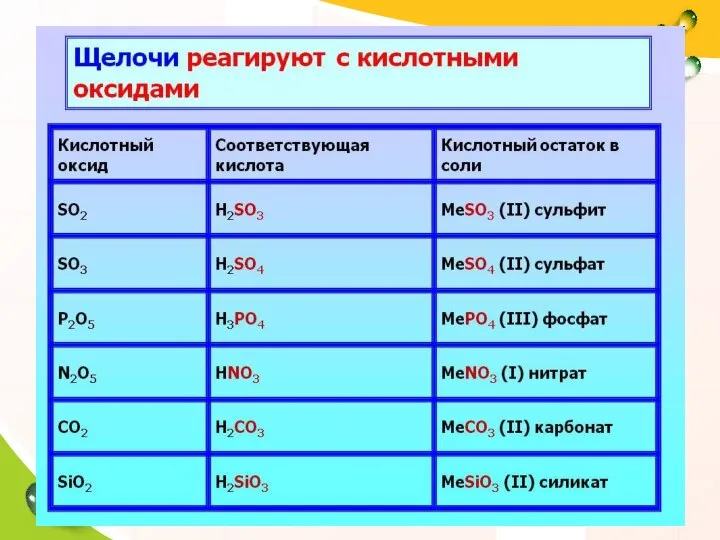
- 17. Химические свойства щелочей. 1). Изменяют окраску индикаторов. Взаимодействуют с: 2). кислотами (реакция нейтрализации), 3). кислотными оксидами,
- 18. ПРАВИЛА БЕЗОПАСНОСТИ Едкое вещество—щелочь! Разрушает и раздражает кожу, слизистые оболочки. Попавшие на кожу капли раствора щелочи
- 19. 1). Щелочи изменяют окраску индикаторов. Индикаторы – от лат. «indication» - указатели NaOH NaOH NaOH Лакмус
- 20. Щелочь + кислота : Ва(ОН)2 + 2НСl = ВаСl2 + 2Н2О хлорид бария Химические свойства щелочей:
- 21. 3. Щелочь + кислотный оксид: Химические свойства щелочей: ! В ходе реакции образуется соль и вода
- 24. Скачать презентацию

















 Хлор. Нахождение в природе
Хлор. Нахождение в природе Соли как производные кислот и оснований. Цель урока: 1.Дать определение солей. 2. Рассмотреть состав и название солей. 3. Продолжить
Соли как производные кислот и оснований. Цель урока: 1.Дать определение солей. 2. Рассмотреть состав и название солей. 3. Продолжить Химия и автомобиль
Химия и автомобиль Амины. Классификация аминов
Амины. Классификация аминов Структура, фазовый состав и спектрально-люминесцентные свойства твердых растворов La1-xNdxGa0,5Sb1,5O6
Структура, фазовый состав и спектрально-люминесцентные свойства твердых растворов La1-xNdxGa0,5Sb1,5O6 Интеллектуальная игра по теме: «Периодический закон и система химических элементов Д.И. Менделеева». «Химический дом и его обитат
Интеллектуальная игра по теме: «Периодический закон и система химических элементов Д.И. Менделеева». «Химический дом и его обитат Многообразие органических веществ
Многообразие органических веществ Окислительно-восстановительные реакции с электронной точки зрения
Окислительно-восстановительные реакции с электронной точки зрения Презентация на тему Карбоновые кислоты и их производные
Презентация на тему Карбоновые кислоты и их производные  Рівняння характеристики крупності
Рівняння характеристики крупності Коды Менделеева
Коды Менделеева Получение пластмасс
Получение пластмасс Химические реакции. Реакции по фазовому составу
Химические реакции. Реакции по фазовому составу Аммиак
Аммиак Общая характеристика элементов группы, главной подгруппы
Общая характеристика элементов группы, главной подгруппы Химические уравнения. 8 класс
Химические уравнения. 8 класс Нефть и продукты ее переработки. Лабораторная работа
Нефть и продукты ее переработки. Лабораторная работа Строение веществ
Строение веществ Расчет физических свойств нефтепродуктов. Практическая работа 1
Расчет физических свойств нефтепродуктов. Практическая работа 1 Ядро атома (тест)
Ядро атома (тест) Основные химические законы
Основные химические законы Общие свойства металлов
Общие свойства металлов Презентация на тему: Чистые вещества и смеси
Презентация на тему: Чистые вещества и смеси Согласованное и несогласованное действие заместителей в бензольном кольце
Согласованное и несогласованное действие заместителей в бензольном кольце Комплексные соединения
Комплексные соединения Металловедение
Металловедение Нефтяные дисперсные системы
Нефтяные дисперсные системы Неорганические вещества клетки
Неорганические вещества клетки