Слайд 21.Положение в ПС
Цинк (Zn) располагается в 4 периоде, в II группе, побочной

подгруппе, имеет порядковый номер 30.
Цинк – d-элемент, металл.
Степени окисления минимальная: 0; максимальная: +2
Высший оксид: ZnO – оксид цинка.
Проявляет амфотерные свойства:
ZnO + 2NaOH + H2O ⟶ Na2[Zn(OH)4]
ZnO + 2HCl ⟶ ZnCl2 + H2O
Высший гидроксид: Zn(OH)2 – гидроксид цинка.
Проявляет амфотерные свойства:
Zn(OH)2 + 2NaOH ⟶ Na2[Zn(OH)4]
Zn(OH)2 + 2HCl ⟶ ZnCl2 + 2H2O
Слайд 32.Нахождение в природе
Цинк достаточно распространённый элемент, он содержится в земной коре, практически
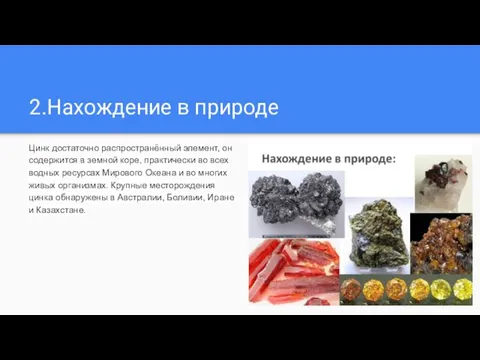
во всех водных ресурсах Мирового Океана и во многих живых организмах. Крупные месторождения цинка обнаружены в Австралии, Боливии, Иране и Казахстане.
Слайд 43.Получение
Пирометаллургический процесс
Оксид цинка сплавляют с коксом при температуре 1250–1350°С в огнеупорных ретортах:
ZnO

+ C = Zn + CO;
пары цинка конденсируются.
Гидрометаллургический процесс
Оксид цинка растворяют в серной кислоте:
ZnO + H2SO4 = ZnSO4 + H2O;
полученный раствор сульфата цинка подвергают электролизу, на катоде выделяется цинк:
2ZnSO4 + 2H2O(электролиз)=2Zn + O2 + 2H2SO4.
Для получения цинка высокой чистоты используют дистилляцию в инертной атмосфере или в вакууме.
Слайд 54.Физические свойства
Температура плавления — 419,58°С.
Температура кипения — 906,2° С.
Изменение температурного режима

активно влияет на изменение физических свойств металлического цинка:
комнатная температура ( 20 °С ) — цинк не пластичен, хрупок,
в диапазоне от 100°С до 150 физические свойства улучшаются, цинк становится пластичен, что активно используют при прокатки цинковых листов и проволоки,
с повышением температуры от 200 до 250°С физические характеристики цинка изменяются в худшею сторону (становится хрупким и ломким).
Слайд 65.1Химические свойства(простые вещества)
1. Цинк – сильный восстановитель. Цинк – довольно активный металл,
но на воздухе он устойчив, так как покрывается тонким слоем оксида, предохраняющим его от дальнейшего окисления. При нагревании цинк реагирует со многими неметаллами.
Цинк реагирует с галогенами с образованием галогенидов:
Zn + I2 → ZnI2
Реакция цинка с иодом при добавлении воды:
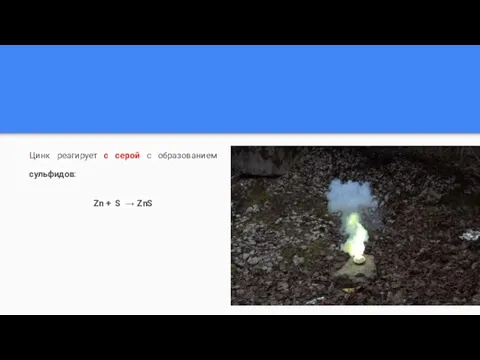
Слайд 7Цинк реагирует с серой с образованием сульфидов:
Zn + S → ZnS
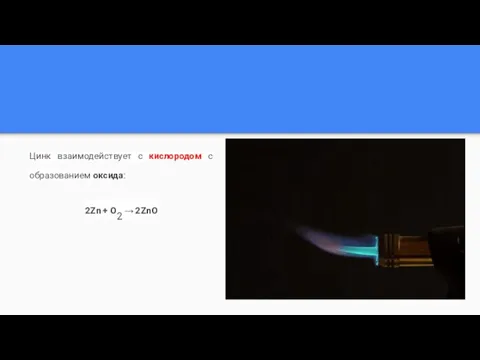
Слайд 8Цинк взаимодействует с кислородом с образованием оксида:
2Zn + O2 → 2ZnO
Слайд 95.2Химические свойства(сложные вещества)
Цинк реагирует с соляной кислотой:
Zn + 2HCl → ZnCl2

+ H2↑
Слайд 10 Цинк – амфотерный металл, он взаимодействует с щелочами. При взаимодействии цинка

с раствором щелочи образуется тетрагидроксоцинкат и водород:
Zn + 2KOH + 2H2O = K2[Zn(OH)4] + H2
Слайд 11Цинк реагирует с парами воды при температуре красного каления с образованием оксида

цинка и водорода:
Zn0 + H2+O → Zn+2O + H20
Слайд 126.Применение
Наносится на поверхность стальных поверхностей для предотвращения процессов коррозии (оцинковка и металлизация);
Используется

для извлечения или восстановления золота, серебра и других металлов;
Применяется в изготовлении некоторых видов аккумуляторов и батареек;
В медицинской практике входит в состав различных антисептических и противовоспалительных средств;
Входит в состав латуни, масляных красок, люминофоров, оптических стекол, флюса для пайки металлов и другие.
Слайд 137.Биологическая роль
является компонентом многих ферментов в организме (известно более 300)
влияет на рост

клеток, особенно во время их репродукции и дифференциации
участвует в обмене нуклеиновых кислот, транскрипции
участвует в обмене белков
участвует в обмене витамина А
поддерживает концентрацию витамина Е в крови, в т.ч. облегчая его всасывание
участвует в связывании некоторых гормонов с соответствующими рецепторами
поддерживает репродуктивную функцию
участвует в кроветворении
участвует в процессах регенерации кожи, секреции сальных желез
участвует в росте ногтей, волос
повышает иммунитет
снижает эффект токсических веществ
участвует в работе вкусовых и обонятельных рецепторов












 Кабинет химии
Кабинет химии 10.1С_Серная кислота
10.1С_Серная кислота Значение воды на Земле
Значение воды на Земле Смеси веществ
Смеси веществ Бериллий (Beryllium) Be
Бериллий (Beryllium) Be 4505ab8713f54e72bb388461c5e134ac (1)
4505ab8713f54e72bb388461c5e134ac (1) Презентация на тему Графен - материал будущего
Презентация на тему Графен - материал будущего  Натрий, свойства атома, химические и физические свойства
Натрий, свойства атома, химические и физические свойства Алкены
Алкены Практикум по химии и технологии нефти и газа
Практикум по химии и технологии нефти и газа Классификация реакций в органической химии
Классификация реакций в органической химии Полупроводниковые твердые растворы
Полупроводниковые твердые растворы Методы исследования структуры кристаллов
Методы исследования структуры кристаллов Изготовление сложнопрофильных изделий из нитрида кремния
Изготовление сложнопрофильных изделий из нитрида кремния Алкины: получение и свойства
Алкины: получение и свойства Оксид марганца
Оксид марганца Презентация на тему Звездный час (9 класс)
Презентация на тему Звездный час (9 класс)  Карбоновые кислоты
Карбоновые кислоты Степень окисления. Классификация неорганических соединений
Степень окисления. Классификация неорганических соединений Водород. История открытия
Водород. История открытия Химический состав клетки
Химический состав клетки Химия цвета
Химия цвета Жиры
Жиры Эмульсии как лиофобные дисперсные системы
Эмульсии как лиофобные дисперсные системы Физические свойства неметаллов
Физические свойства неметаллов Вспомогательные средства для стирки
Вспомогательные средства для стирки Металлы. Определения
Металлы. Определения Понятие о спиртах
Понятие о спиртах