Содержание
- 2. Общая характеристика производных карбоновых кислот. 1. Калия ацетат. 2. Кальция глюконат. 3. Кислота аскорбиновая. Общая характеристика
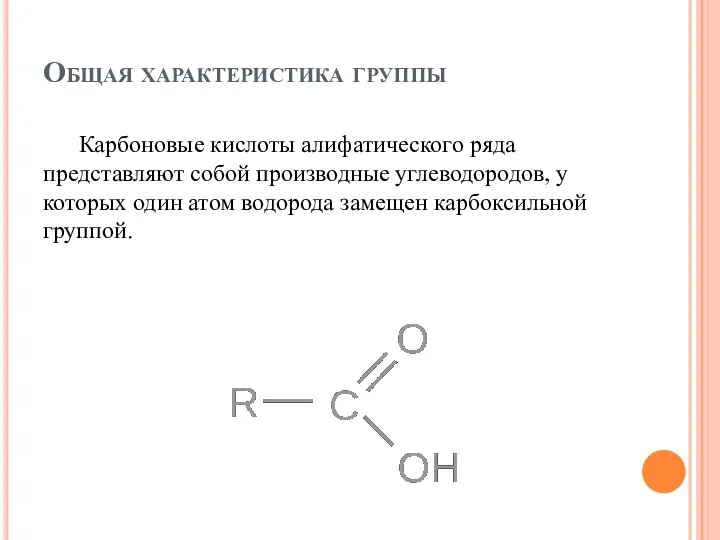
- 3. Общая характеристика группы Карбоновые кислоты алифатического ряда представляют собой производные углеводородов, у которых один атом водорода
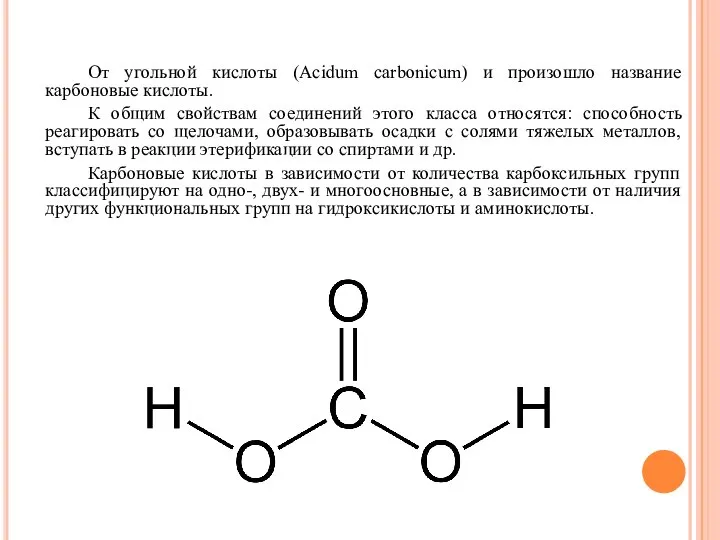
- 4. От угольной кислоты (Acidum carbonicum) и произошло название карбоновые кислоты. К общим свойствам соединений этого класса
- 5. Калия ацетат Это кристаллический порошок белого цвета или бесцветные кристаллы. Расплываются на воздухе. Легко растворимы в
- 6. Количественное определение: Ацидиметрия в неводной среде, индикатор – раствор нафтолбензеина. Ацидиметрия в водной среде (в жидких
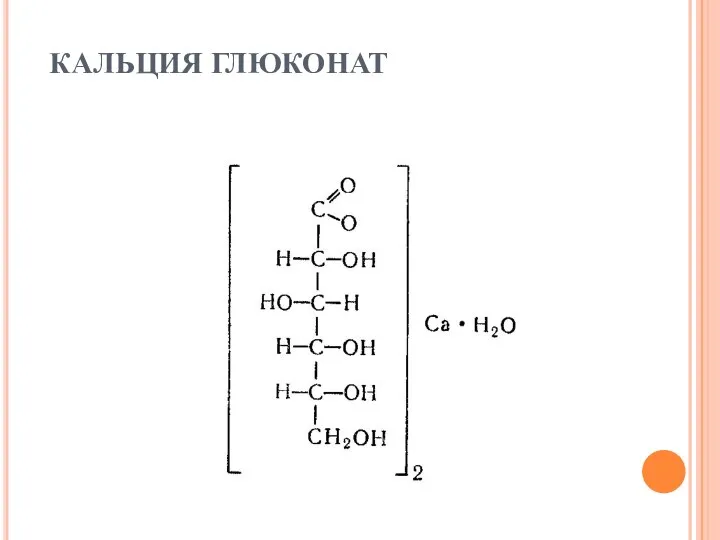
- 7. КАЛЬЦИЯ ГЛЮКОНАТ
- 8. ПОЛУЧЕНИЕ Получение электрохимическим окислением глюкозы в присутствии карбоната кальция и бромида кальция, используемого как окислитель. В
- 9. ОПИСАНИЕ Белый зернистый или кристаллический порошок без запаха и вкуса. Медленно растворим в воде, легко в
- 10. ПОДЛИННОСТЬ Реакции на катион кальция: 1. Пирохимическая – пламя окрашивается в кирпично-красный цвет На глюконат анион:
- 11. КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ 1.Метод комплексонометрии (Фармакопейный метод) Навеску препарата растворяют в воде при нагревании. После охлаждают прибавляют
- 12. ПРИМЕНЕНИЕ Источник ионов кальция, антиаллергическое средство. Препарат легко усваивается и не вызывает раздражения при подкожном и
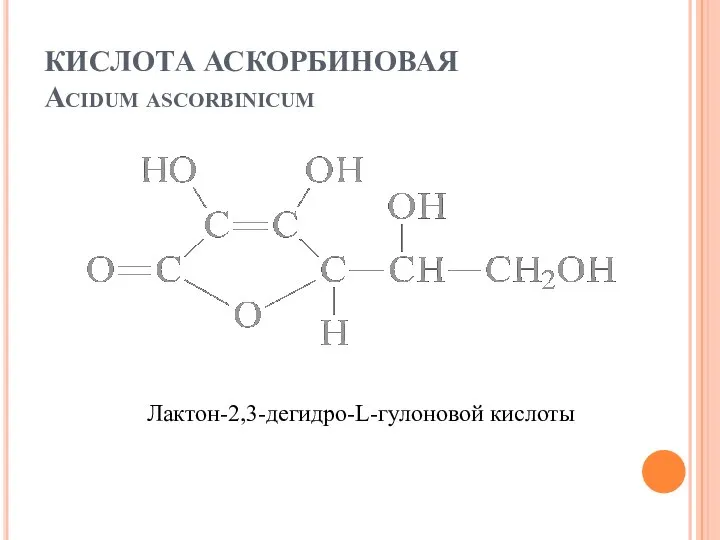
- 14. КИСЛОТА АСКОРБИНОВАЯ Acidum ascorbinicum Лактон-2,3-дегидро-L-гулоновой кислоты
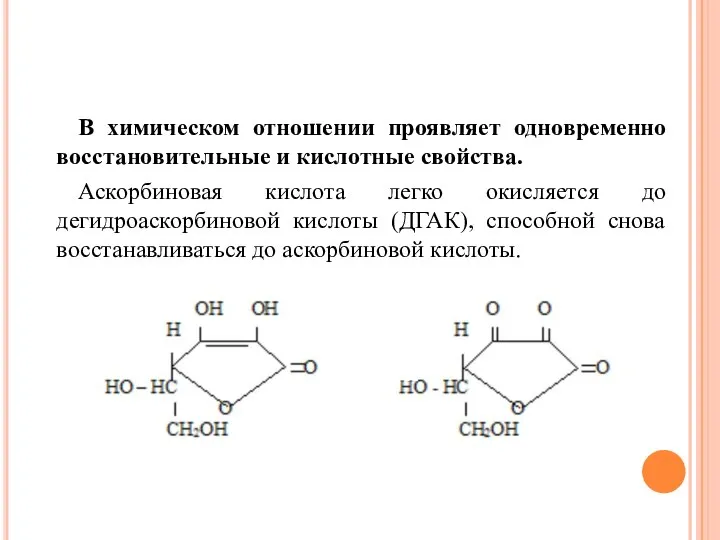
- 15. В химическом отношении проявляет одновременно восстановительные и кислотные свойства. Аскорбиновая кислота легко окисляется до дегидроаскорбиновой кислоты
- 16. ОПИСАНИЕ Белый кристаллический порошок без запаха, кислого вкуса. Легко растворим в воде, медленно растворим в 90%
- 17. ПОЛУЧЕНИЕ В промышленности синтез аскорбиновой кислоты осуществляется из глюкозы, которая в больших количествах получается при расщеплении
- 18. ПОДЛИННОСТЬ: Угол вращения поляриметрический. Поглощение в ультрафиолетовой области спектра. Химические свойства. Кислота так же проявляет восстановительные
- 19. Количественное определение: Йодатометрия (фармакопейный метод). Метод основан на окислении аскорбиновой кислоты. Точную навеску препарата растворяют в
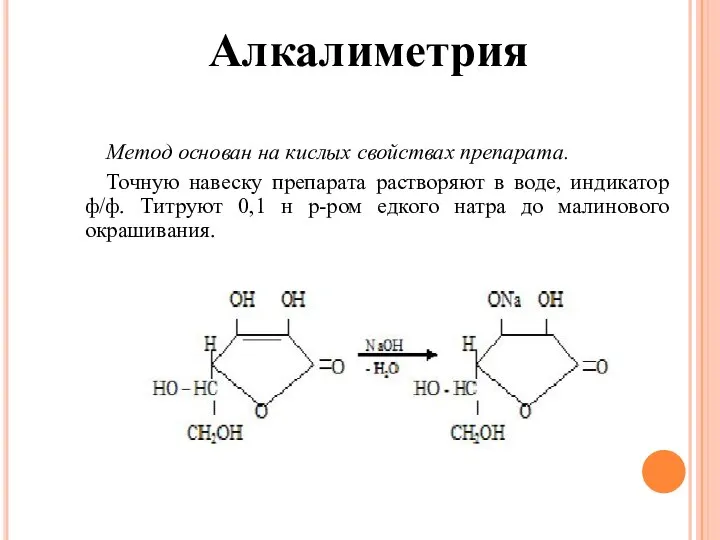
- 20. Алкалиметрия Метод основан на кислых свойствах препарата. Точную навеску препарата растворяют в воде, индикатор ф/ф. Титруют
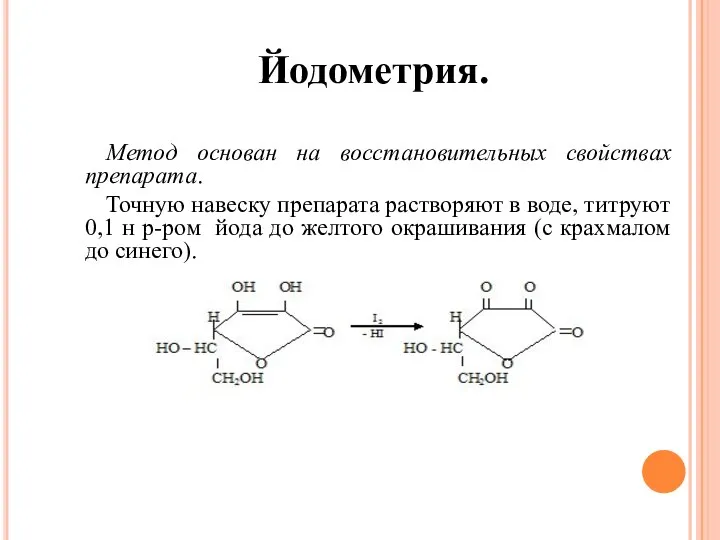
- 21. Йодометрия. Метод основан на восстановительных свойствах препарата. Точную навеску препарата растворяют в воде, титруют 0,1 н
- 22. Применение: Витамин С Назначают с целью профилактики и лечения инфекционных заболеваний, при интоксикациях, кровотечениях различной этиологии.
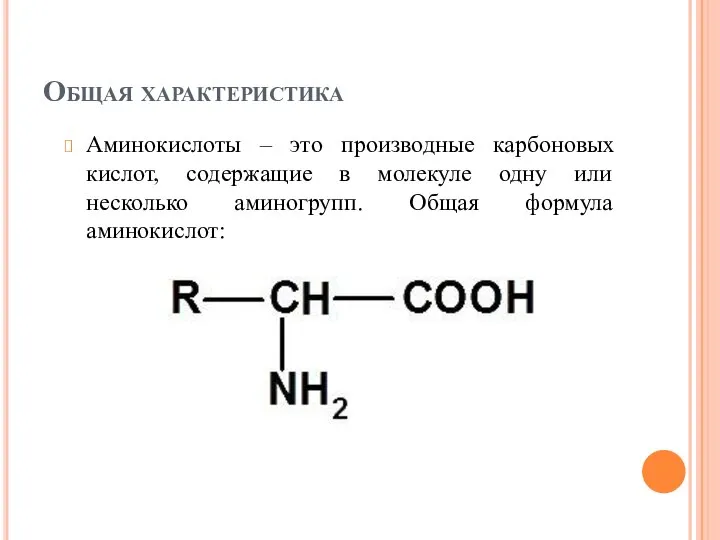
- 24. Общая характеристика Аминокислоты – это производные карбоновых кислот, содержащие в молекуле одну или несколько аминогрупп. Общая
- 25. Природные аминокислоты алифатического ряда – бесцветные, белые и желтоватого оттенка кристаллические субстанции, чаще хорошо растворимые в
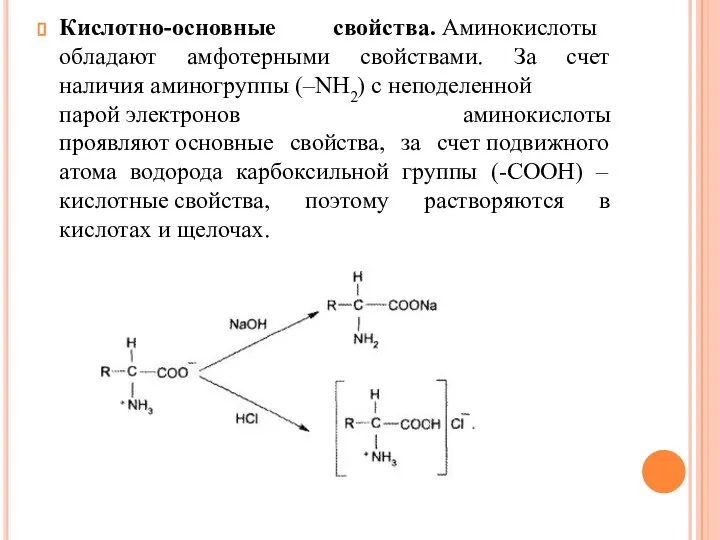
- 26. Кислотно-основные свойства. Аминокислоты обладают амфотерными свойствами. За счет наличия аминогруппы (–NH2) c неподеленной парой электронов аминокислоты
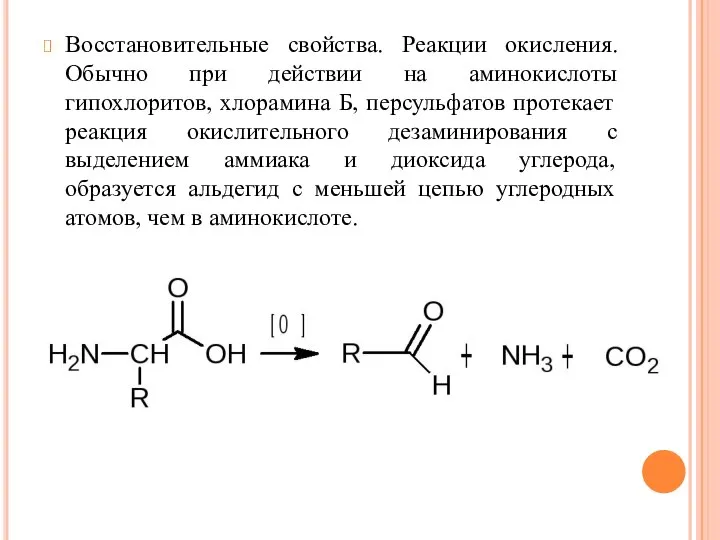
- 27. Восстановительные свойства. Реакции окисления. Обычно при действии на аминокислоты гипохлоритов, хлорамина Б, персульфатов протекает реакция окислительного
- 28. Аминокислоты можно разделить на 2 группы: - «заменимые» - аминокислоты, которые синтезируются в организме в количестве,
- 29. Структура и физические свойства аминокислот алифатического ряда По физическим свойствам аминокислоты алифатического ряда в своём большинстве
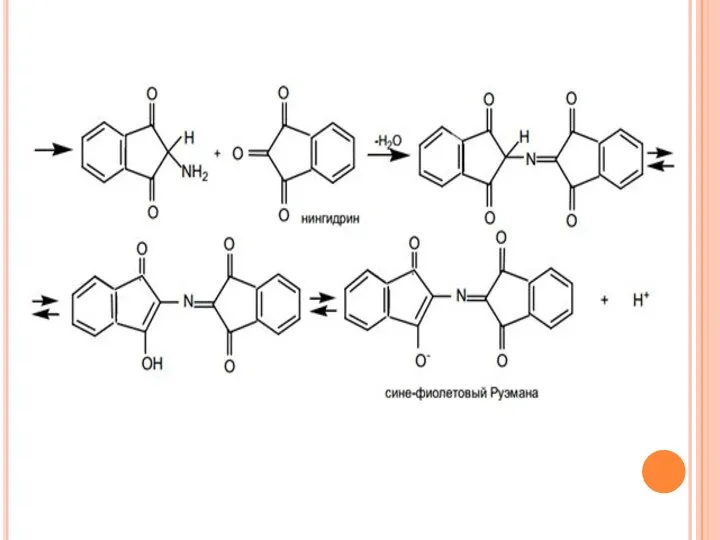
- 30. Идентификация Общие групповые реакции аминокислот. Нингидриновая проба является общей реакцией для аминокислот, которую дают все аминокислоты
- 32. Реакция комплексообразования с солями тяжёлых металлов. Для идентификации аминокислот широко используется их способность за счёт карбоксильной
- 34. Реакция сплавления с тиоцианатом калия. При этом образуется сплав черного цвета. Пробирку закрывают бумагой, смоченной раствором
- 35. Образование основания Шиффа. При взаимодействии аминокислот с альдегидами образуются замещенные имины (основания Шиффа) через стадию образования
- 36. Методы количественного определения Выделяют несколько методов количественного определения: Метод алкалиметрический по Серенсену, способ прямого титрования, индикатор
- 37. Алкалиметрический метод прямого титрования щелочью в присутствии индикаторов бромтимолового синего или нейтрального красного (до оранжевого окрашивания).
- 38. Микрометод Кьельдаля. Все операции проводят аналогично классическому методу, но используют аппарат для автоматического определения азота. Видоизменённый
- 39. Кислотно-основное титрование в смешанных растворителях. Данным методом определяют кислоту аминокапроновую. Данный препарат титруют 0,1 М раствором
- 40. Иодатометрический метод используется для определения каптоприла. Точную навеску каптоприла (около 0,3 г) растворяют в 100 мл
- 41. Йодохлорметрический метод. При йодхлорометрическом титровании метионин окисляется до соответствующего сульфоксида. Комплексонометрия используется для количественного определения дисульфирама,
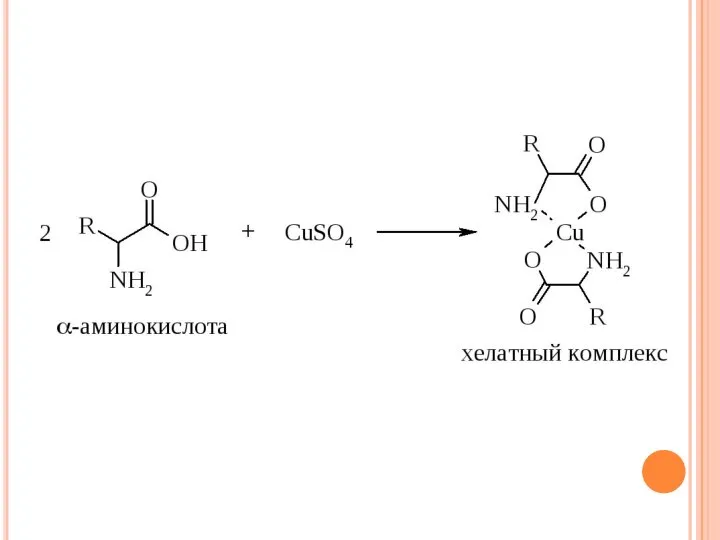
- 42. Фотоколориметрия. Для количественного определения аминокислот используется реакция с ионами меди (ІІ), сопровождающаяся образованием хелатных комплексов. Выделяющиеся
- 43. Спектрофотометрический метод. Метионин и кислоту глутаминовую идентифицируют с помощью ИК-спектров по совпадению полос поглощения в области
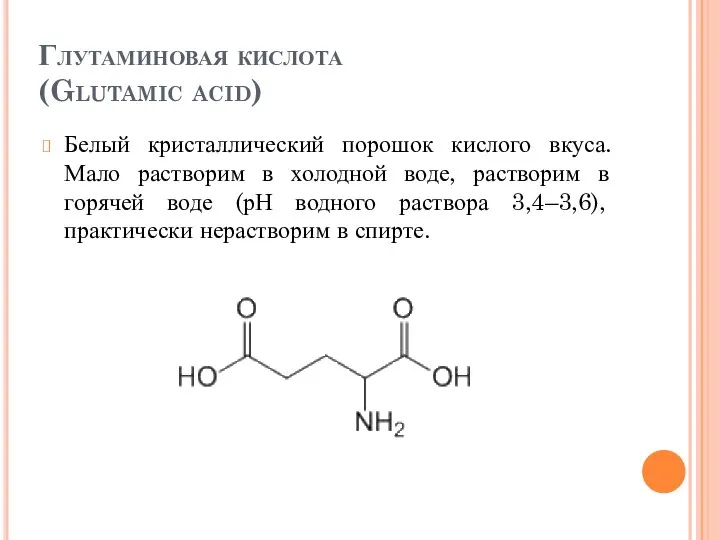
- 44. Глутаминовая кислота (Glutamic acid) Белый кристаллический порошок кислого вкуса. Мало растворим в холодной воде, растворим в
- 45. Физические свойства Глутаминовая кислота представляет собой растворимые в воде кристаллы с температурой плавления 2020С. Это кристаллическая
- 46. Получение кислоты глутаминовой и метионина. Кислоту глутаминовую и метионин получают гидролизом белковых веществ. В миозине, козеине,
- 47. Количественное определение 1. Алкалиметрия: индикатор – бромтимоловый синий. 2. Формольное титрование по Серенсену. 3. Метод определения
- 48. Хранение: в хорошо укупоренной таре, предохраняющей от действия света. Применение: лечение заболеваний ЦНС, эпилепсии, психозов, реактивных
- 49. Кислота аминокапроновая Aminocproic acid Описание: бесцветные кристаллы или белый кристаллический порошок без запаха. Растворимость: легко растворим
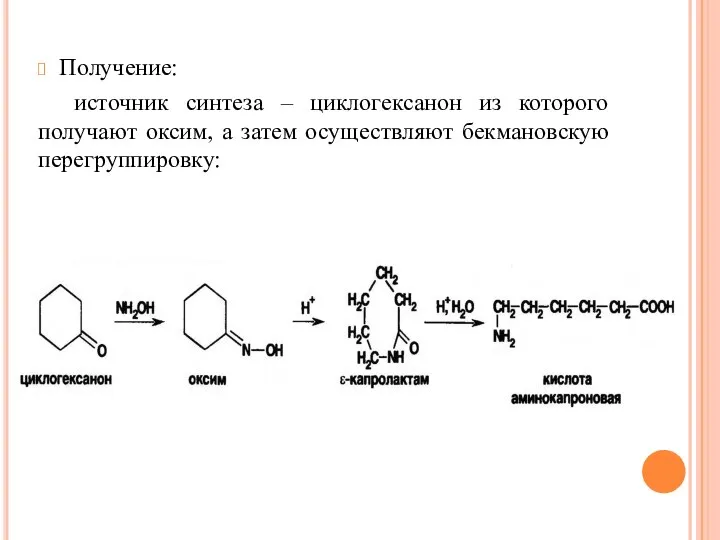
- 50. Получение: источник синтеза – циклогексанон из которого получают оксим, а затем осуществляют бекмановскую перегруппировку:
- 51. Идентификация 1. Цветная реакция с аллоксаном в среде кипящей водяной бане. Окрашивание: ярко-малиновы цвет. 2. Окисление
- 52. Количественное определение 1. Метод Къельдаля – определение органически связанного азота. Метод основан на предварительной минерализации аминокислот
- 54. Применение вещества Глутаминовая кислота Эпилепсия (преимущественно малые припадки с эквивалентами), шизофрения, психозы (соматогенные, интоксикационные, инволюционные), реактивные
- 55. Противопоказания Гиперчувствительность, лихорадка, печеночная и/или почечная недостаточность, нефротический синдром, язвенная болезнь желудка и двенадцатиперстной кишки, заболевания
- 57. Скачать презентацию






































 Elektroliz_Gidroliz
Elektroliz_Gidroliz Основания. Формулы двух амфотерных оксидов
Основания. Формулы двух амфотерных оксидов Окислительно-восстановительные реакции. Типы химических реакций
Окислительно-восстановительные реакции. Типы химических реакций Презентация на тему Химический алфавит
Презентация на тему Химический алфавит  Методы диагностики плазмы
Методы диагностики плазмы Реакции ионного обмена
Реакции ионного обмена Растворы вокруг нас
Растворы вокруг нас Классификация неорганических веществ
Классификация неорганических веществ Алмашу реакциясе
Алмашу реакциясе Аммиак NH3
Аммиак NH3 Презентация на тему Кристаллические решетки
Презентация на тему Кристаллические решетки  Определение качества дизельного топлива
Определение качества дизельного топлива Изменение агрегатных состояний вещества
Изменение агрегатных состояний вещества Презентация на тему Знаешь ли ты классы неорганических веществ
Презентация на тему Знаешь ли ты классы неорганических веществ  Карбоновые кислоты
Карбоновые кислоты Комментарии к выполненным заданиям по темам растворы и электролитическая диссоциация. 8 класс
Комментарии к выполненным заданиям по темам растворы и электролитическая диссоциация. 8 класс Азотосодержащие органические соединения
Азотосодержащие органические соединения Изомерия и ее виды
Изомерия и ее виды Соединения щелочных металлов
Соединения щелочных металлов Металлы и их соединения
Металлы и их соединения Химический элемент калий
Химический элемент калий Презентация на тему Подгруппа углерода
Презентация на тему Подгруппа углерода  Комплексонометрия. Способы комплексонометрического титрования
Комплексонометрия. Способы комплексонометрического титрования Амфотерные соединения Амфотерными называют соединения, которые в зависимости от условий могут быть как донорами катионов водоро
Амфотерные соединения Амфотерными называют соединения, которые в зависимости от условий могут быть как донорами катионов водоро Валентность. Составление формул по валентности
Валентность. Составление формул по валентности Массовая доля растворённого вещества
Массовая доля растворённого вещества Природный источник нефть
Природный источник нефть Химический элемент. Изотопы. Ионы
Химический элемент. Изотопы. Ионы