Содержание
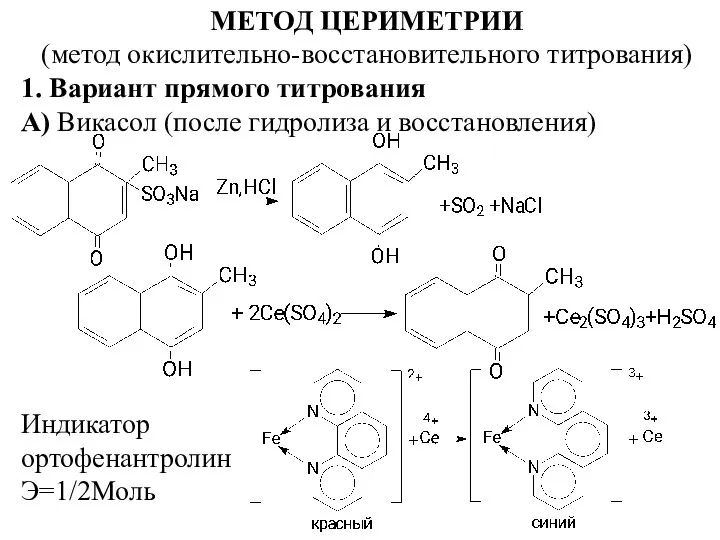
- 2. МЕТОД ЦЕРИМЕТРИИ (метод окислительно-восстановительного титрования) 1. Вариант прямого титрования А) Викасол (после гидролиза и восстановления) Индикатор
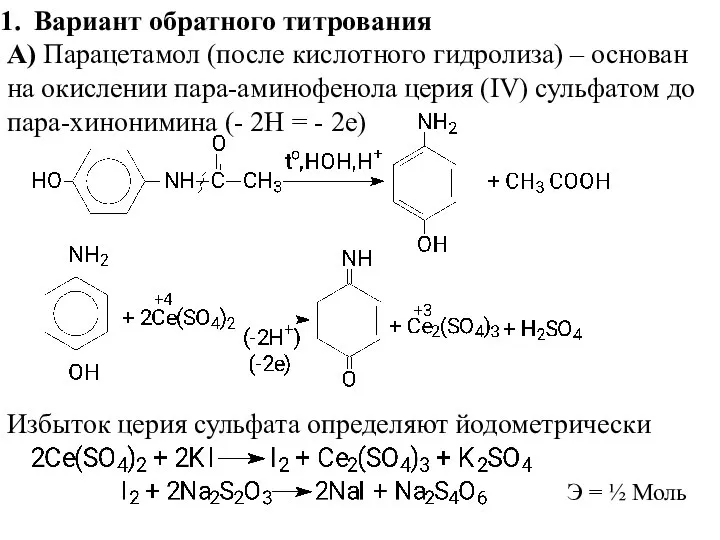
- 3. Вариант обратного титрования А) Парацетамол (после кислотного гидролиза) – основан на окислении пара-аминофенола церия (IV) сульфатом
- 4. Продолжение Б) Раствор формальдегида (вариант обратного титрования), основан на окислении формальдегида до Муравьиной (метановой) кислоты Э
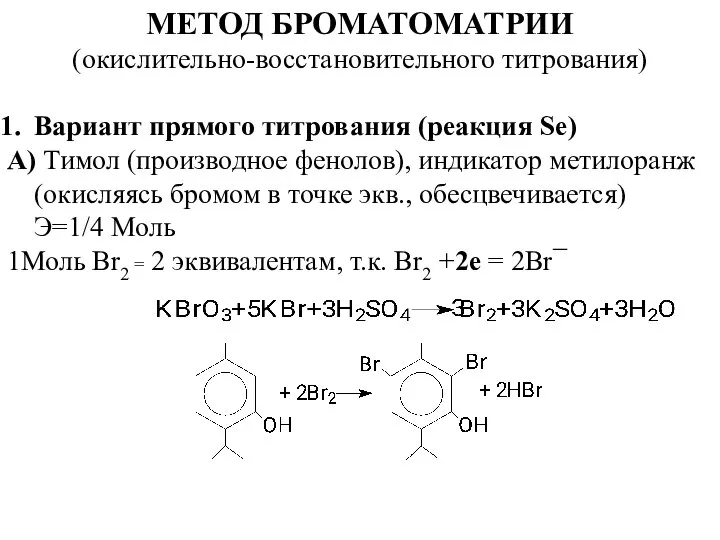
- 5. МЕТОД БРОМАТОМАТРИИ (окислительно-восстановительного титрования) Вариант прямого титрования (реакция Se) А) Тимол (производное фенолов), индикатор метилоранж (окисляясь
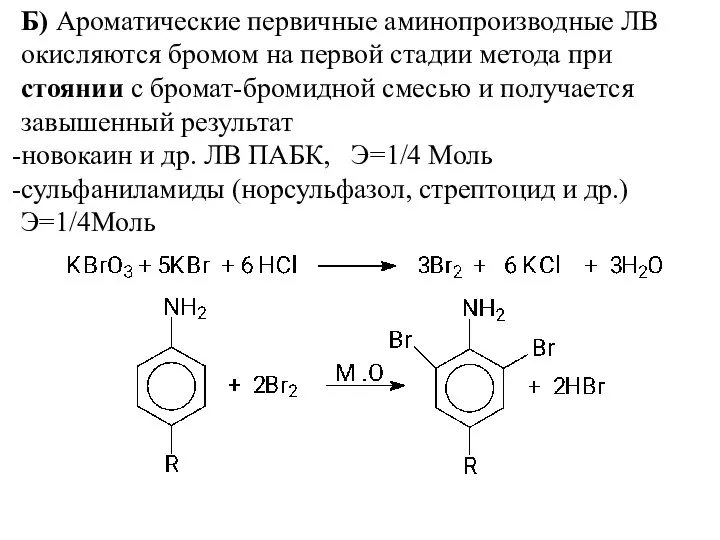
- 6. Б) Ароматические первичные аминопроизводные ЛВ окисляются бромом на первой стадии метода при стоянии с бромат-бромидной смесью
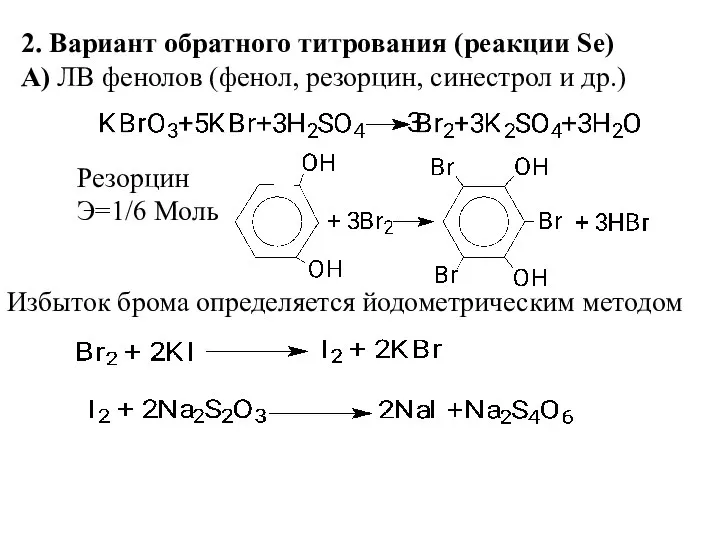
- 7. 2. Вариант обратного титрования (реакции Se) А) ЛВ фенолов (фенол, резорцин, синестрол и др.) Резорцин Э=1/6
- 8. Б) Салициловая кислота и ее Na соль, бромирование идет с декарбоксилированием, Э=1/6 Моль Натрия салицилат В)
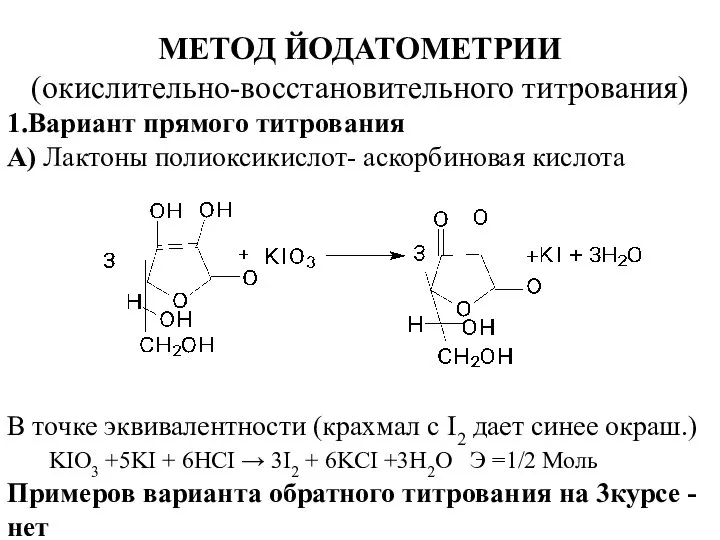
- 9. МЕТОД ЙОДАТОМЕТРИИ (окислительно-восстановительного титрования) 1.Вариант прямого титрования А) Лактоны полиоксикислот- аскорбиновая кислота В точке эквивалентности (крахмал
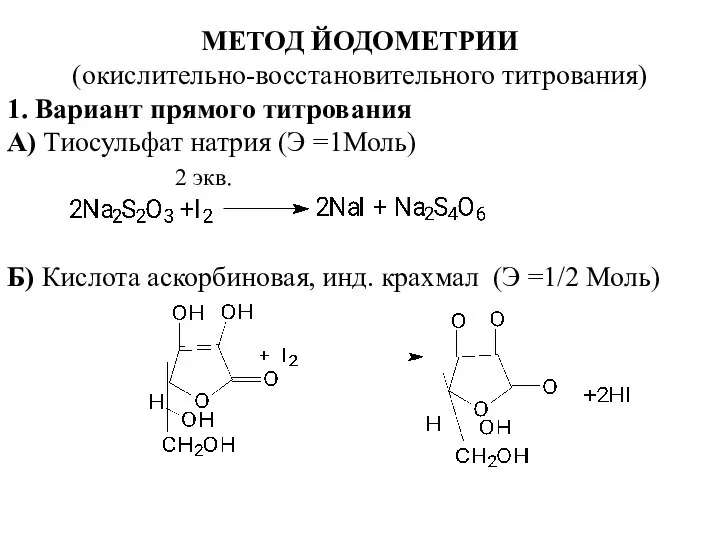
- 10. МЕТОД ЙОДОМЕТРИИ (окислительно-восстановительного титрования) 1. Вариант прямого титрования А) Тиосульфат натрия (Э =1Моль) 2 экв. Б)
- 11. 2. Вариант обратного титрования А) Альдегидопроизводные ЛВ, окисление в щелочной среде (формальдегид, хлоралгидрат в среде NaOH,
- 12. В) Вариант обратного титрования для органических оснований: первичных –норадреналин, вторичных –эфедрин и др. арилалкиламины, третичных –димедрол,
- 13. Д) Алифатические серосодержащие аминокислоты (цистеин, метионин), окисление по R-SH или R-S-R1 Цистеин, Э = 1 Моль
- 14. 3. Вариант косвенного титрования Меди сульфат, выделившийся йод титруют натрия тиосульфатом, восстановление меди(II) до меди(I), Э
- 15. МЕТОД ЙОДХЛОРМЕТРИИ Вариант обратного титрования А) Реакция Se – ЛВ фенолов (резорцин и др.), ароматических перв.
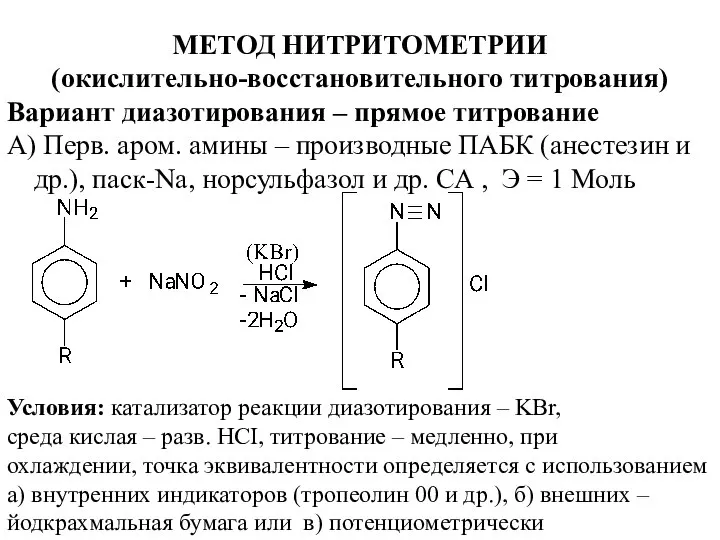
- 16. МЕТОД НИТРИТОМЕТРИИ (окислительно-восстановительного титрования) Вариант диазотирования – прямое титрование А) Перв. аром. амины – производные ПАБК
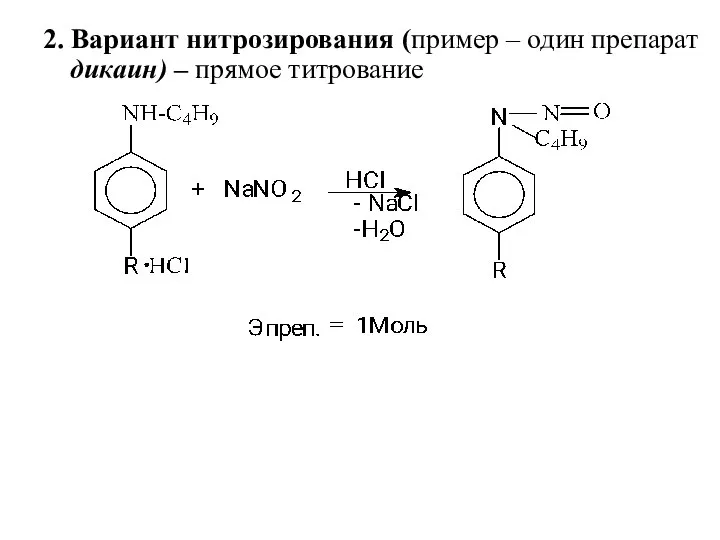
- 17. 2. Вариант нитрозирования (пример – один препарат дикаин) – прямое титрование
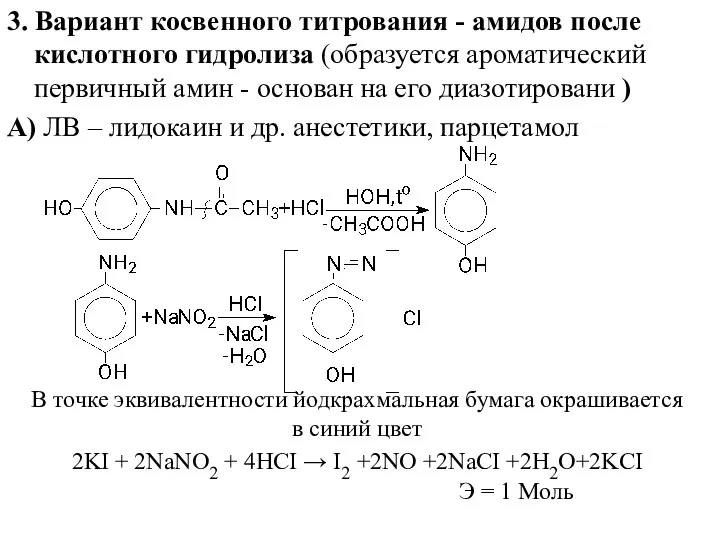
- 18. 3. Вариант косвенного титрования - амидов после кислотного гидролиза (образуется ароматический первичный амин - основан на
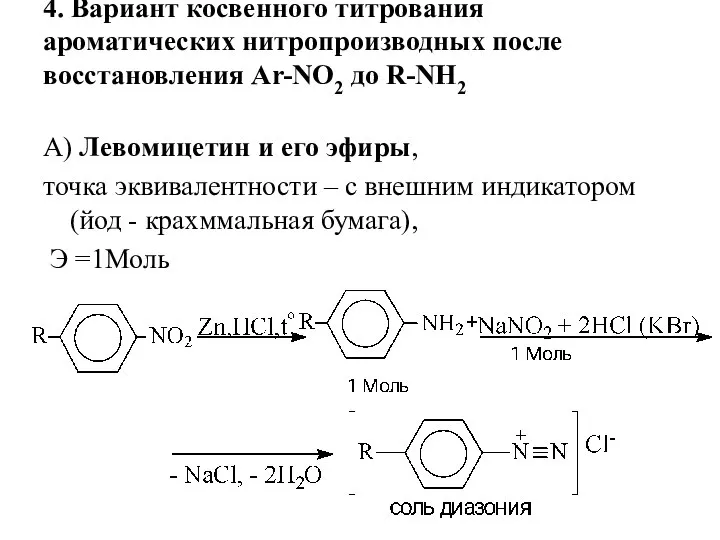
- 19. 4. Вариант косвенного титрования ароматических нитропроизводных после восстановления Ar-NO2 до R-NH2 А) Левомицетин и его эфиры,
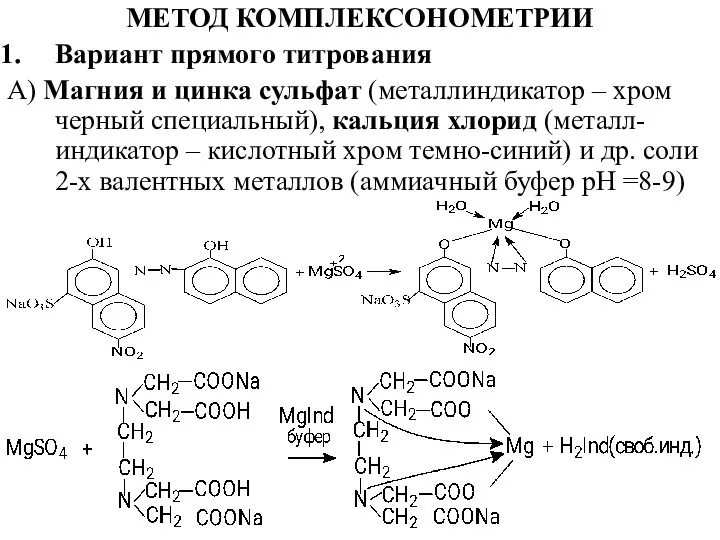
- 20. МЕТОД КОМПЛЕКСОНОМЕТРИИ Вариант прямого титрования А) Магния и цинка сульфат (металлиндикатор – хром черный специальный), кальция
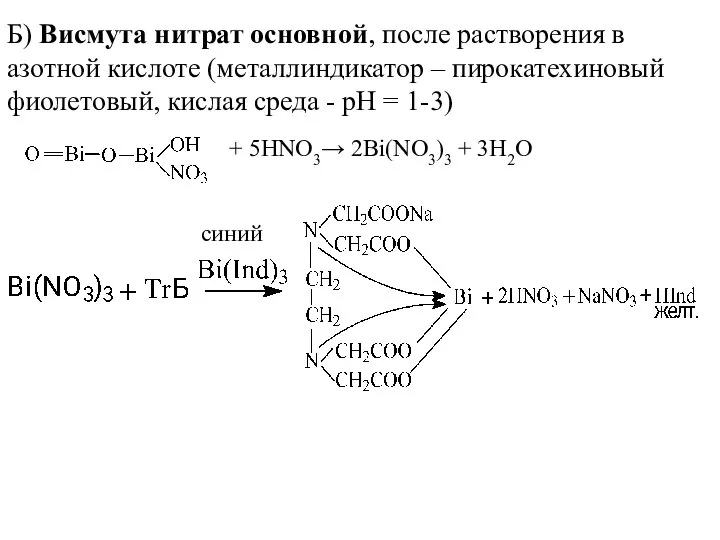
- 21. Б) Висмута нитрат основной, после растворения в азотной кислоте (металлиндикатор – пирокатехиновый фиолетовый, кислая среда -
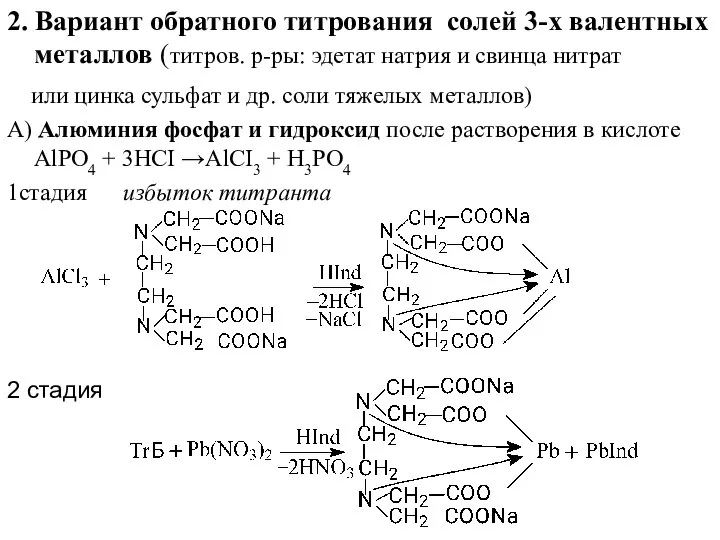
- 22. 2. Вариант обратного титрования солей 3-х валентных металлов (титров. р-ры: эдетат натрия и свинца нитрат или
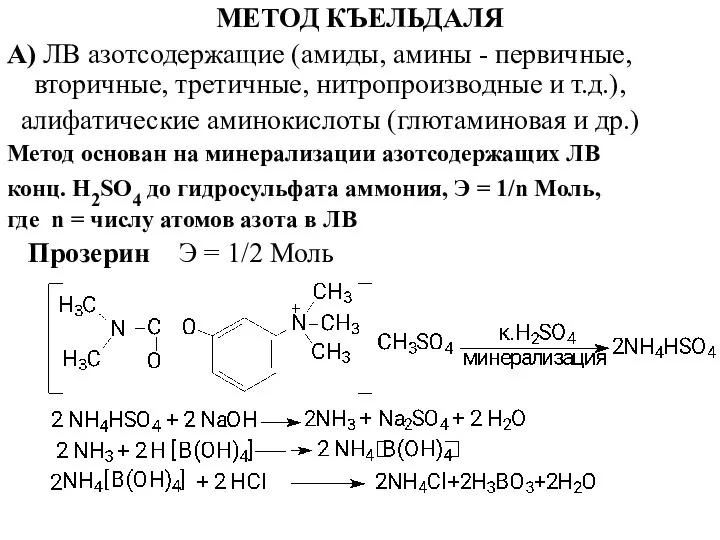
- 23. МЕТОД КЪЕЛЬДАЛЯ А) ЛВ азотсодержащие (амиды, амины - первичные, вторичные, третичные, нитропроизводные и т.д.), алифатические аминокислоты
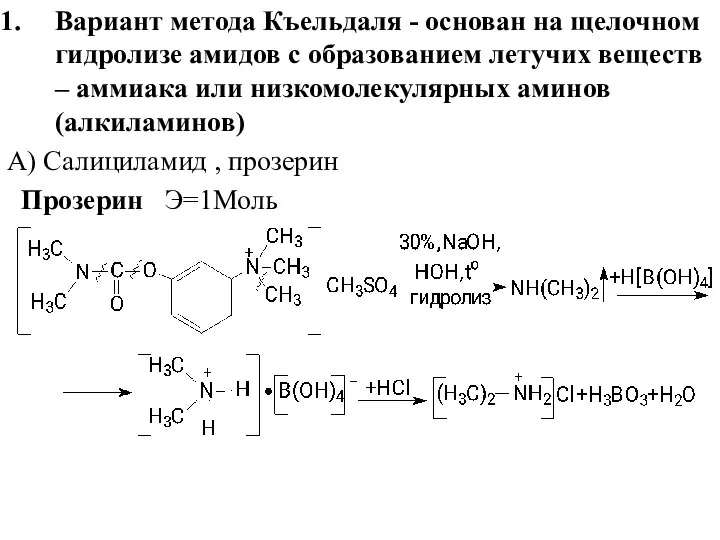
- 24. Вариант метода Къельдаля - основан на щелочном гидролизе амидов с образованием летучих веществ – аммиака или
- 25. МЕТОД МЕРКУРИМЕТРИИ (осадительного титрования) А) Неорг. ЛВ – галогениды щелочных металлов (натрия и калия хлориды, йодиды,
- 26. Б) Орг. ЛВ – соли HГаL кислот и органических третичных, вторичных оснований (новокаина г/хл и др.
- 27. Методы аргентометрии I. Методы аргентометрии для ЛП неорганической природы Метод Мора - Cl¯,Br¯(ФС) - титруют в
- 28. Метод Фаянса – для Cl¯, Br¯, I¯ с адсорбционными индикаторами: для Cl¯, Br¯ - бромфеноловый синий
- 29. . Метод Фольгарда – Cl¯, Br¯, I¯(неоф.) вариант обратного титрования, индикатор – железоаммониевые квасцы 1 стадия:
- 30. Метод Кольгофа – I¯ (не мешают Cl¯, Br¯) р-р NaI + 0,1н. KIO3 + крахмал +
- 31. II. Методы аргентометрии для лекарственных препаратов –солей галогеноводородных кислот и органических оснований Метод Мора и др.
- 33. Скачать презентацию














 Оксиды. Классификация оксидов
Оксиды. Классификация оксидов Классификация химических реакций по различным основаниям
Классификация химических реакций по различным основаниям Альдегиды. Кетоны
Альдегиды. Кетоны Амины. Аминокислоты. Белки
Амины. Аминокислоты. Белки Аналитическая химия. Введение
Аналитическая химия. Введение Закон сохранения массы
Закон сохранения массы Кремний и его соединения
Кремний и его соединения Презентация на тему Каучуки
Презентация на тему Каучуки  Дисперсные системы
Дисперсные системы Спирты. Классификация, номенклатура, изомерия, получение и применение. 10 класс
Спирты. Классификация, номенклатура, изомерия, получение и применение. 10 класс Характеристика химических элементов IV А группа. Углерод
Характеристика химических элементов IV А группа. Углерод Значение периодического закона для современной науки и техники (связь химии с экономикой и экологией) Учитель химии МОУ лицея
Значение периодического закона для современной науки и техники (связь химии с экономикой и экологией) Учитель химии МОУ лицея  Буферные растворы
Буферные растворы Полиморфизм кристаллов изатина
Полиморфизм кристаллов изатина Умники и умницы в Королевстве Химических наук
Умники и умницы в Королевстве Химических наук Поверхностные и массовые силы. Вывод уравнения неразрывности сплошной однокомпонентной среды
Поверхностные и массовые силы. Вывод уравнения неразрывности сплошной однокомпонентной среды Презентация на тему Выбирай вопрос и отвечай
Презентация на тему Выбирай вопрос и отвечай  Аморфные и кристаллические вещества
Аморфные и кристаллические вещества Элемент первой группы, калий
Элемент первой группы, калий Исследовательская работа на тему: «Выращивание кристалла в домашних условиях» Работу выполнила ученица 10-а класса Алексеева О
Исследовательская работа на тему: «Выращивание кристалла в домашних условиях» Работу выполнила ученица 10-а класса Алексеева О Физические и фазовые состояния полимеров
Физические и фазовые состояния полимеров Радиоакивные металлы
Радиоакивные металлы Портландцемент гидравликалық байланыстырғыш
Портландцемент гидравликалық байланыстырғыш Классификация углеводов
Классификация углеводов Домашняя работа на каникулы
Домашняя работа на каникулы Использование ИКТ в преподавании химии
Использование ИКТ в преподавании химии Металлы и их соединения
Металлы и их соединения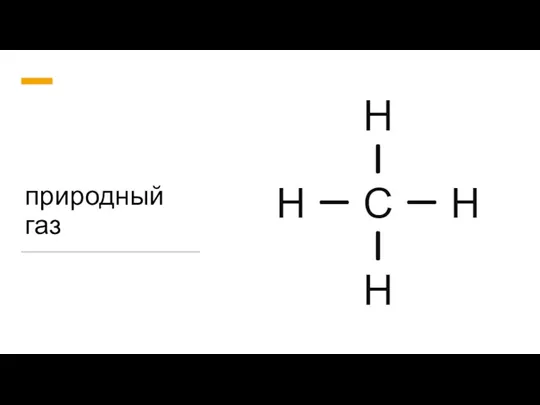 Природный газ
Природный газ