Содержание
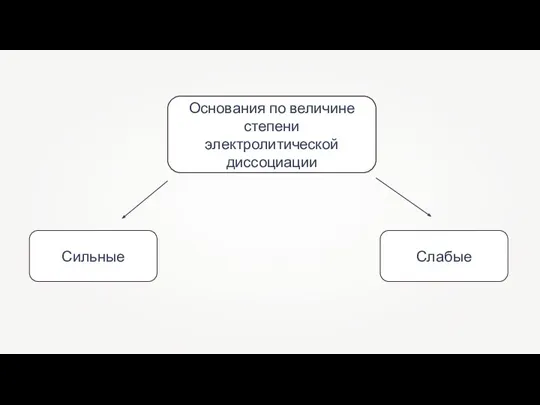
- 2. Основания по величине степени электролитической диссоциации
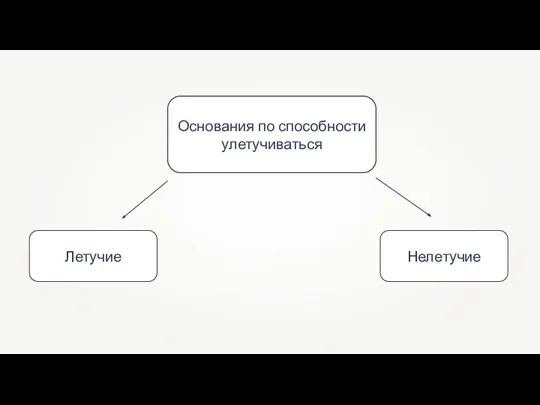
- 3. Основания по способности улетучиваться
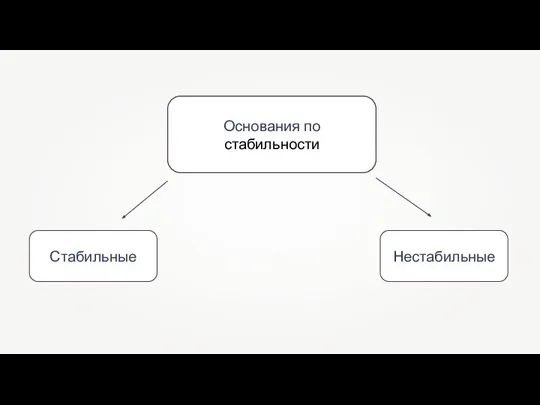
- 4. Основания по стабильности
- 6. Взаимодействие оснований с кислотами 2NaOH + H2SO4 = Na2SO4 + 2H2O При взаимодействии гидроксида натрия с
- 7. Взаимодействие оснований с кислотами NH3 + HCl = NH4Cl При взаимодействии бескислородных оснований с кислотами образуется
- 8. Взаимодействие щелочей с кислотными оксидами 2NaOH + SO3 = Na2SO4 + H2O Взаимодействовать с кислотными оксидами
- 9. К взаимодействию с солями склонны только щёлочи. Причём в данном случае реакция пойдёт, если в результате
- 10. Взаимодействие щелочей с солями 2NaOH + СuCl2 = 2NaCl + Cu(OH)2 Обычно в результате взаимодействия между
- 12. Скачать презентацию






 Периодическая система Д.И.Менделеева
Периодическая система Д.И.Менделеева Белки
Белки Презентация на тему Кристаллическая решетка
Презентация на тему Кристаллическая решетка  Классификация аминокислот в зависимости от природы радикалов
Классификация аминокислот в зависимости от природы радикалов Синтетические органические соединения
Синтетические органические соединения Синтез индолов по Неницеску
Синтез индолов по Неницеску Взаимодействие кислот с металлами
Взаимодействие кислот с металлами Химические свойства
Химические свойства Чугуны
Чугуны Окислительно- восстановительные реакции
Окислительно- восстановительные реакции Скорость химической реакции
Скорость химической реакции Технология растворов на неводных растворителях
Технология растворов на неводных растворителях Презентация на тему Интересные факты из жизни великого учёного Д. И. Менделеева
Презентация на тему Интересные факты из жизни великого учёного Д. И. Менделеева 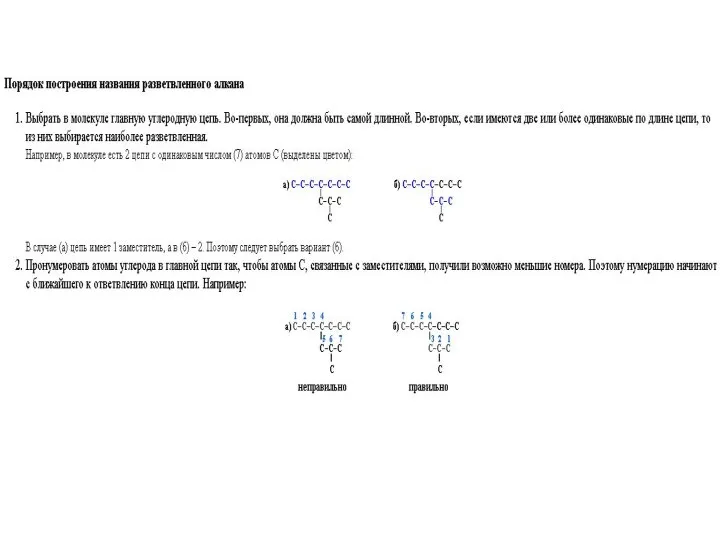 Номенклатура алканов РВЛ
Номенклатура алканов РВЛ Презентация на тему Эфирные масла
Презентация на тему Эфирные масла  Еще раз про электролиз…
Еще раз про электролиз… 1
1 Гидролиз солей
Гидролиз солей Ovr-1
Ovr-1 Кремний и его соединения
Кремний и его соединения Простые и сложные вещества (8 класс)
Простые и сложные вещества (8 класс) Содержание варианта ЕГЭ
Содержание варианта ЕГЭ Prezentatsia_Microsoft_PowerPoint
Prezentatsia_Microsoft_PowerPoint Водород – первый элемент в периодической таблице
Водород – первый элемент в периодической таблице Юный химик. Интерактивная интеллектуальная игра
Юный химик. Интерактивная интеллектуальная игра Аллиты, ферриты, манганаты
Аллиты, ферриты, манганаты alkany_alkeny_alkiny_
alkany_alkeny_alkiny_ Номенклатура органических соединений
Номенклатура органических соединений