Содержание
- 2. У металлов есть враг, который приводит к огромным безвозвратным потерям металлов, ежегодно полностью разрушается около 10%
- 3. Проблема защиты металлов от коррозии возникла почти в самом начале их использования. Люди пытались защитить металлы
- 4. В III до нашей эры на острове Родос был построен маяк в виде огромной статуи Гелиоса.
- 5. В 20 годы ХХ в. по заказу одного миллионера была построена роскошная яхта “Зов моря”. Еще
- 6. Что является символом Парижа? –Эйфелева башня. Она неизлечима больна, ржавеет и разрушается, и только постоянная химиотерапия
- 7. Коррозия – разрушение металлов и сплавов под воздействием окружающей среды. Слово коррозия происходит от латинского corrodere,
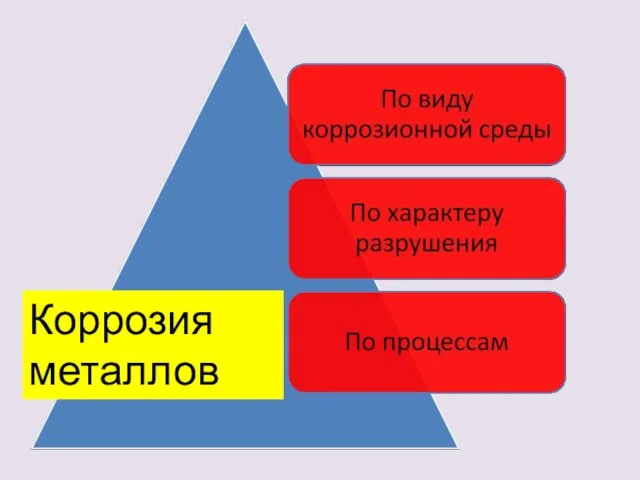
- 8. Коррозия металлов
- 9. По виду коррозионной среды газовая; жидкостная: - кислотная, щелочная, - солевая; атмосферная; почвенная.
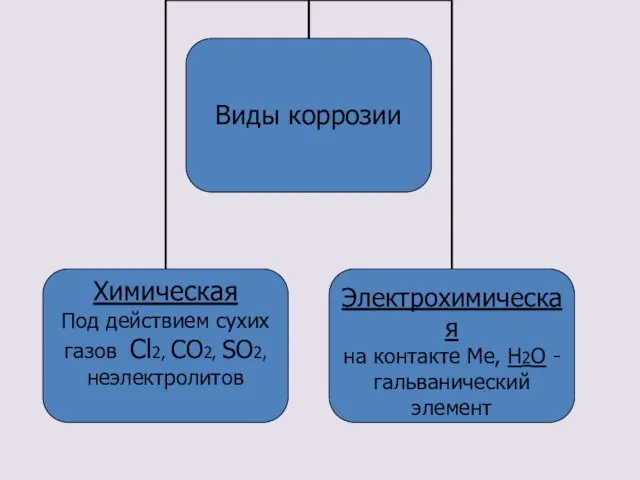
- 10. Виды коррозии
- 12. Химическая коррозия Химическая коррозия – это взаимодействие металлов с сухими газами и жидкостями – неэлектролитами. Такому
- 13. Компоненты окружающей среды окисляют непосредственно металл. Протекающие при химической коррозии окислительно - восстановительные реакции осуществляются путем
- 14. 1813 г. Гемфри Деви открыл электрохимическую коррозию металлов
- 15. Электрохимическая коррозия Электрохимическая коррозия – это все случаи коррозии в присутствии воды и жидкостей – электролитов.
- 16. Коррозия на контакте двух металлов Fe/Cu 2+ Fe - 2ē ?Fe разрушение на меди: + 2Н
- 17. Химизм коррозии.
- 18. 1 группа – щелочные металлы – наименьшая коррозийная стойкость.(побочная подгруппа – весьма стойкие металлы) 2 группа
- 19. 3 группа – алюминий – образуется прочная оксидная пленка ( но она разрушается в растворах кислот
- 20. 5,6,7,8группы – металлы побочных подгрупп обладают высокой способностью к пассивации, а следовательно, большой коррозионной стойкостью. осмий,
- 21. Сущность коррозии Коррозия состоит из двух процессов: химического – это отдача электронов и электрического – это
- 22. Закономерности коррозии: 1. Если соединены два разных металла, то коррозии подвергается только более активный, и пока
- 23. Закономерности коррозии: 2. Скорость коррозии тем больше, чем дальше друг от друга в ряду напряжений расположены
- 24. Способы защиты от коррозии Одним из наиболее распространенных способов защиты металлов от коррозии является нанесение на
- 25. Широко распространенным способом защиты металлов от коррозии является покрытие их слоем других металлов. Покрывающие металлы сами
- 26. Покрытие другими металлами.
- 27. В повседневной жизни человек чаще всего встречается с покрытиями железа цинком и оловом. Листовое железо, покрытое
- 28. Способы защиты от коррозии. Создание сплавов с антикоррозионными свойствами. Для этого в основной металл добавляют до
- 29. Способы защиты от коррозии. Изменение состава среды. Для замедления коррозии вводятся ингибиторы. Это вещества, которые замедляют
- 30. Способы защиты от коррозии. Применение ингибиторов – один из эффективных способов борьбы с коррозией металлов в
- 31. Электрозащита. 1. Протекторная защита. К основной конструкции прикрепляются заклёпки или пластины из более активного металла, которые
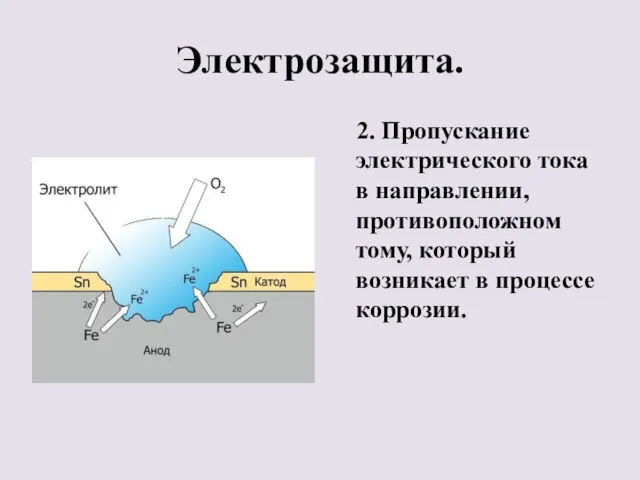
- 32. Электрозащита. 2. Пропускание электрического тока в направлении, противоположном тому, который возникает в процессе коррозии.
- 34. Скачать презентацию




























 Класс оксиды
Класс оксиды Методы разделения катализаторов и продуктов, используемые для гомогенно-каталитических реакционных систем
Методы разделения катализаторов и продуктов, используемые для гомогенно-каталитических реакционных систем ТЭЦ, работающие на каменном угле более экологичны, чем на буром. Факт или вымысел?
ТЭЦ, работающие на каменном угле более экологичны, чем на буром. Факт или вымысел? Углерод и его свойства
Углерод и его свойства Химия и нанотехнологии
Химия и нанотехнологии Химическая связь. Строение вещества
Химическая связь. Строение вещества Классификация углеводов
Классификация углеводов Mechanika płynów
Mechanika płynów Алхимики в Средние века
Алхимики в Средние века Техника безопасности на уроках химии
Техника безопасности на уроках химии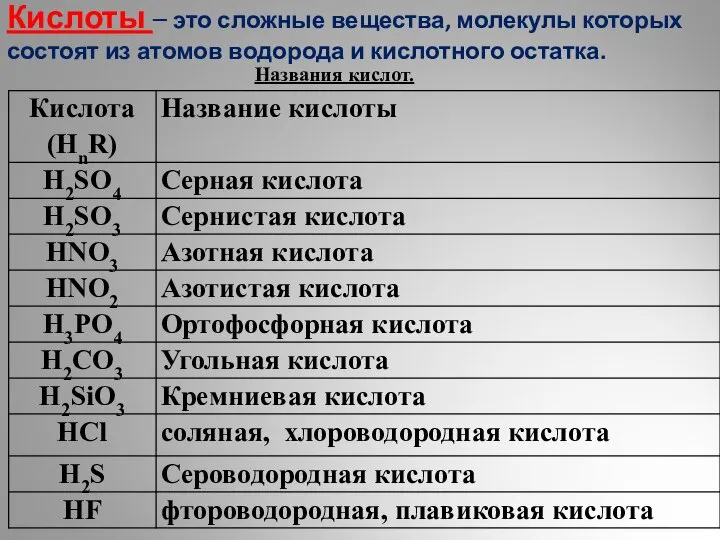 Кислоты. Классификация
Кислоты. Классификация Классификация органических соединений
Классификация органических соединений Физические свойства неметаллов
Физические свойства неметаллов Вывод и обсуждение
Вывод и обсуждение Строение веществ
Строение веществ Поделочный камень родонит
Поделочный камень родонит Материалы в промышленности
Материалы в промышленности Химия элементов (IБ) группы
Химия элементов (IБ) группы Химическая связь
Химическая связь Азотсодержащие гетероциклические соединения пиррол
Азотсодержащие гетероциклические соединения пиррол Гидролиз солей
Гидролиз солей Количественный анализ. Титрование
Количественный анализ. Титрование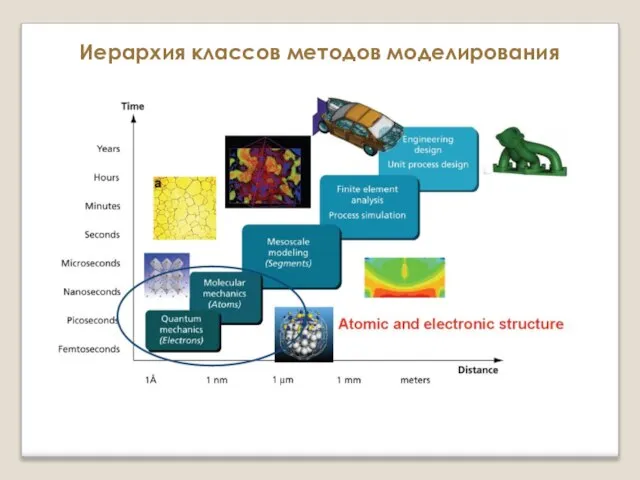 Поверхность потенциальной энергии и расчет сил, действующих на ионы
Поверхность потенциальной энергии и расчет сил, действующих на ионы Простые вещества – металлы. Физические свойства металлов. Сплавы
Простые вещества – металлы. Физические свойства металлов. Сплавы Определение формул органических веществ. Задачи для самостоятельного решения
Определение формул органических веществ. Задачи для самостоятельного решения Жиры. Определение и общая формула
Жиры. Определение и общая формула Альфа- и бета- распад. Правило смещения
Альфа- и бета- распад. Правило смещения Этапы приготовления и микроскопического исследования нативного препарата осадка мочи
Этапы приготовления и микроскопического исследования нативного препарата осадка мочи