Содержание
- 2. План занятия Основные понятия химии Состав веществ. Изменение веществ Основные законы химии. Обозначения, названия и единицы
- 3. !!!! Сделать краткий конспект основных понятий и законов Выполнить задания в конце презентации Для проверки скинуть
- 4. Основные понятия химии.
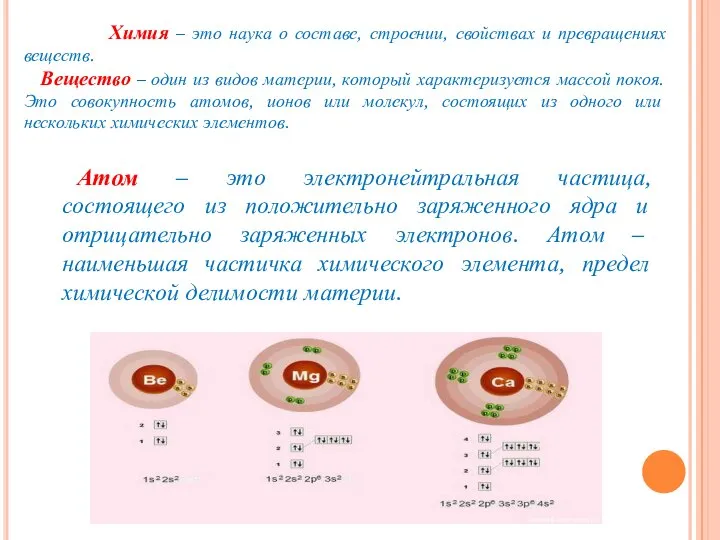
- 5. Атом – это электронейтральная частица, состоящего из положительно заряженного ядра и отрицательно заряженных электронов. Атом –
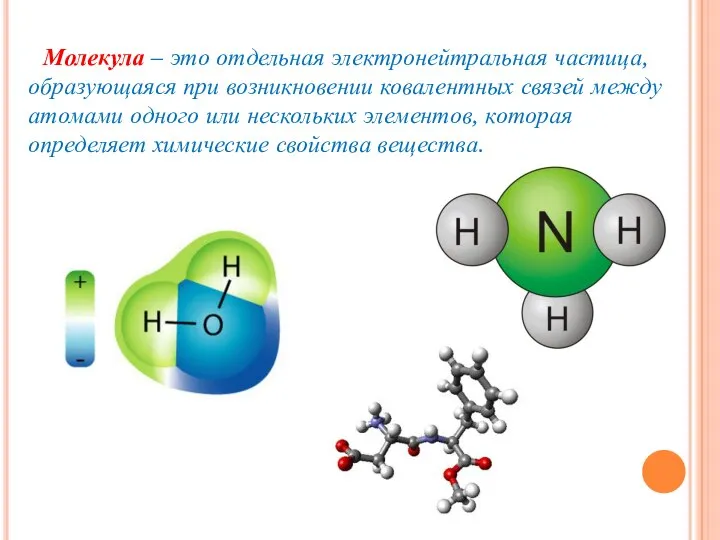
- 6. Молекула – это отдельная электронейтральная частица, образующаяся при возникновении ковалентных связей между атомами одного или нескольких
- 7. Химический элемент – это совокупность атомов с одинаковым зарядом ядра. Например: сера S, углерод C, кальций
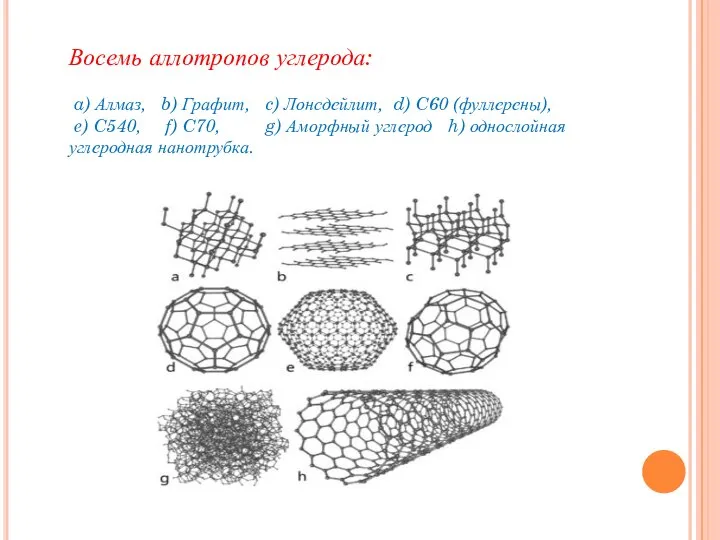
- 9. Восемь аллотропов углерода: a) Алмаз, b) Графит, c) Лонсдейлит, d) C60 (фуллерены), e) C540, f) C70,
- 10. Состав веществ. Изменение веществ.
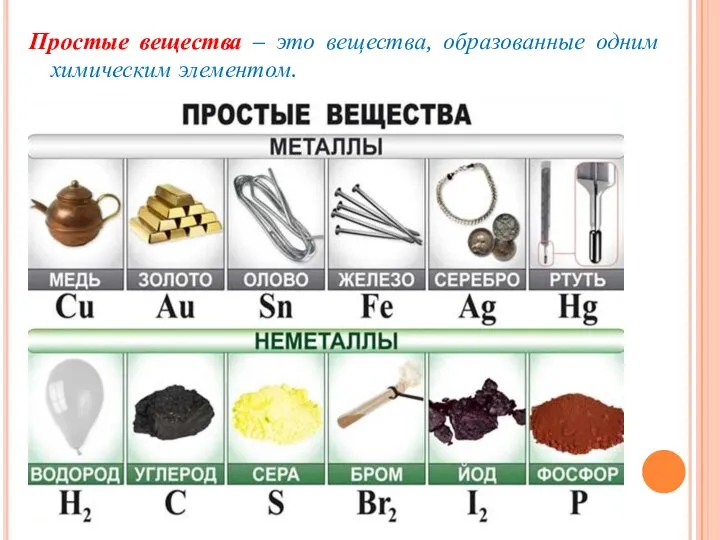
- 11. Простые вещества – это вещества, образованные одним химическим элементом.
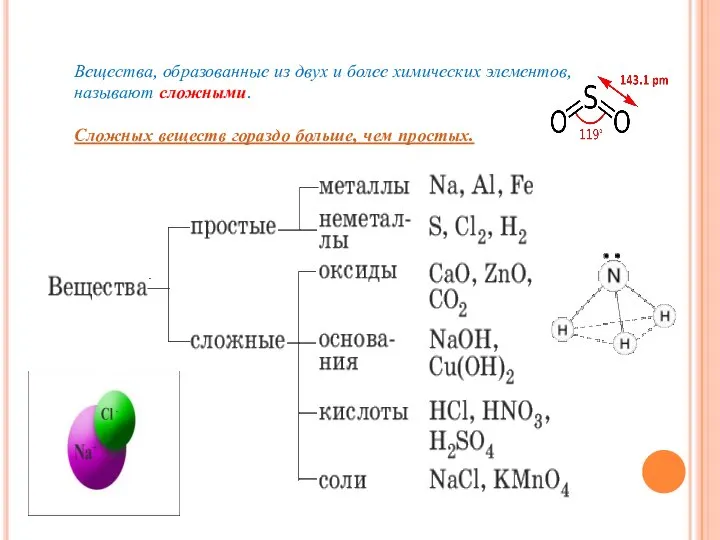
- 12. Вещества, образованные из двух и более химических элементов, называют сложными. Сложных веществ гораздо больше, чем простых.
- 13. Различают в качественный и количественный состав веществ. Качественный состав – это совокупность химических элементов и (или)
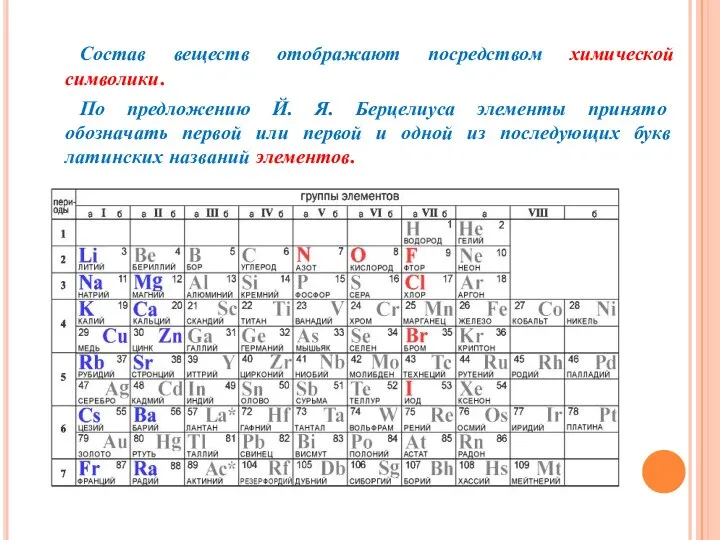
- 14. Состав веществ отображают посредством химической символики. По предложению Й. Я. Берцелиуса элементы принято обозначать первой или
- 15. Химический знак (символ) – несет значительную информацию. Он обозначает название элемента, один его атом, один моль
- 16. Химическая формула – это способ отображения химического состава вещества. Она обозначает название вещества, одну молекулу его,
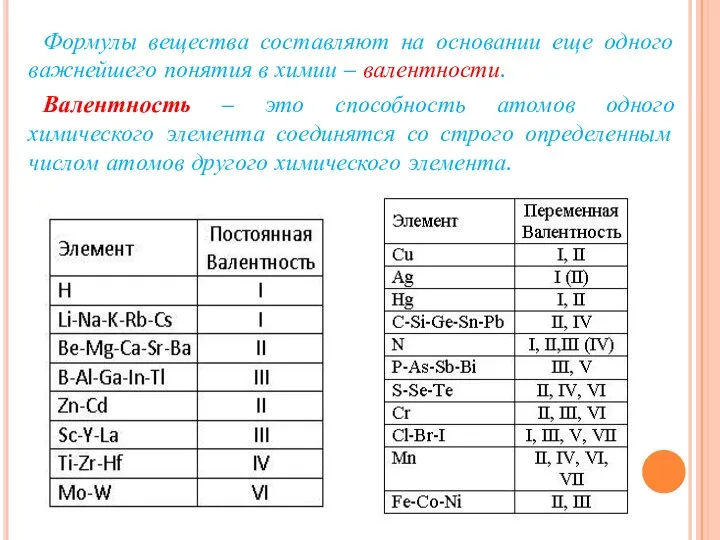
- 17. Формулы вещества составляют на основании еще одного важнейшего понятия в химии – валентности. Валентность – это
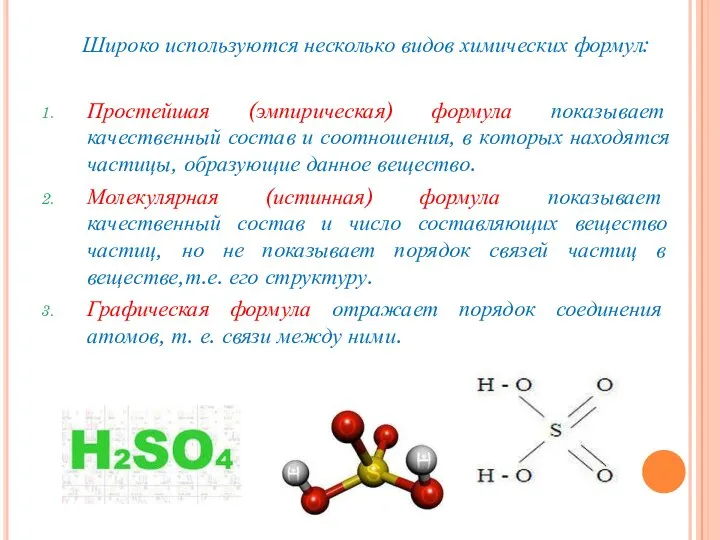
- 18. Широко используются несколько видов химических формул: Простейшая (эмпирическая) формула показывает качественный состав и соотношения, в которых
- 19. Относительная атомная масса ( ) химического элемента – это величина, показывающая отношение средней массы атома природной
- 20. Относительная атомная масса – одна из основных характеристик химического элемента. Относительная молекулярная масса ( ) равна
- 21. Количество вещества (n или v) характеризуют числом атомов, молекул или других формульных единиц данного вещества. В
- 22. Молярная масса может быть выражена через число молекул (или атомов) в одном моле вещества ( )
- 23. Из этого выражения можно определить число молекул или атомов, содержащихся в одном месте любого вещества, которое
- 24. Основные законы химии
- 25. Закон сохранения массы. Был открыт М. В. Ломоносовым (1748г.) и сформулирован А. Лавуазье (1789г.): Масса веществ,
- 26. Закон постоянства состава вещества. Сформулирован Ж.-Л. Прустом в 1799 г.: все индивидуальные вещества имеют постоянный качественный
- 27. Современная формулировка закона постоянства состава вещества таков: Состав соединений молекулярной структуры является постоянным независимо от способа
- 28. Из закона Авогадро вытекают 2 следствия: Один моль любого газа при одинаковых условиях занимает один и
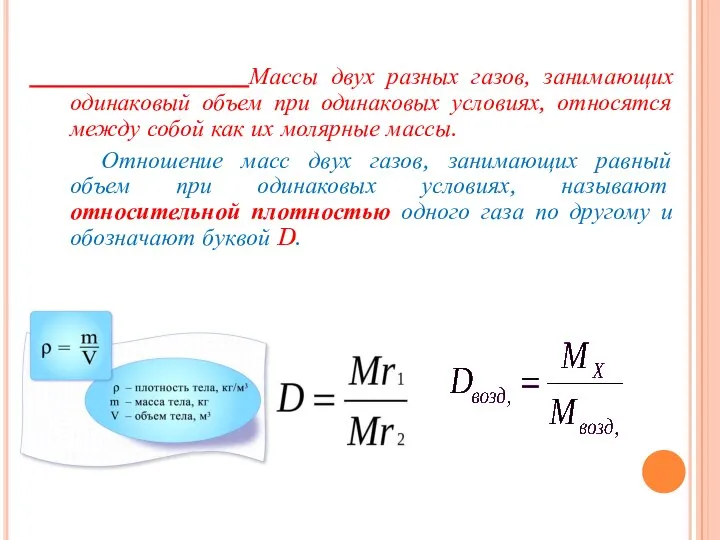
- 29. Массы двух разных газов, занимающих одинаковый объем при одинаковых условиях, относятся между собой как их молярные
- 30. Уравнение состояния идеального газа (уравнение Менделеева-Клапейрона) или где p – давление; V – объем газа; m
- 31. Задания для закрепления: Тест по теме «Предмет химии. Вещества». 1) Что изучает наука химия? Это наука
- 32. 6) Вещество: 1. Медная проволока 2.Медная монета 3. Медная пластина 4.Медь 7) Простое вещество: 1.Водород 2.Углекислый
- 34. Скачать презентацию




















 Алмашу реакциясе
Алмашу реакциясе Материальный и тепловой балансы абсорбции
Материальный и тепловой балансы абсорбции Понятия и законы в химии. (Лекция 1)
Понятия и законы в химии. (Лекция 1) Основные сведения о строении атома. Состав атомных ядер
Основные сведения о строении атома. Состав атомных ядер Основные понятия химической термодинамики
Основные понятия химической термодинамики Презентация на тему Теория строения органических соединений
Презентация на тему Теория строения органических соединений  Конкурс О, химия – ты муза вдохновения!
Конкурс О, химия – ты муза вдохновения! Алканы, предельные, насыщенные углеводороды (парафины)
Алканы, предельные, насыщенные углеводороды (парафины) Дисперсные системы
Дисперсные системы Важнейшие соединения хлора
Важнейшие соединения хлора Биогенный элемент. Кобальт (Со)
Биогенный элемент. Кобальт (Со) Характеристика металлов по положению в ПСХ
Характеристика металлов по положению в ПСХ Знаки химических элементов
Знаки химических элементов Диеновые углеводороды
Диеновые углеводороды Азотная кислота
Азотная кислота алотропні модифікації неметалів
алотропні модифікації неметалів Органическая химия как наука. Основные положения теории строения химических соединений. Структурная изомерия
Органическая химия как наука. Основные положения теории строения химических соединений. Структурная изомерия Свойства кремниевой кислоты и области применения силикатов
Свойства кремниевой кислоты и области применения силикатов Потенциометрический анализ, титрование
Потенциометрический анализ, титрование Алкены
Алкены Нефть и газ
Нефть и газ Исследование методов синтеза 5-аминосалициловой кислоты
Исследование методов синтеза 5-аминосалициловой кислоты Алкены.Номенклатура
Алкены.Номенклатура Презентация по Химии "Химическая номенклатура и филология"
Презентация по Химии "Химическая номенклатура и филология"  Аллотропия углерода
Аллотропия углерода Алюминий. Положение алюминия в периодической системе и строение его атома
Алюминий. Положение алюминия в периодической системе и строение его атома Бутан как хладагент
Бутан как хладагент Оңай балқитын флюстерді қолдана отырып хромкенді шекемтастар алу мүмкіндігін зерттеу
Оңай балқитын флюстерді қолдана отырып хромкенді шекемтастар алу мүмкіндігін зерттеу