Содержание
- 2. Прав ли был Артур Конан-Дойл?
- 3. ...Да! Это была собака, огромная, черная, как смоль. Но такой собаки еще никто из нас, смертных,
- 4. Открытие фосфора Фосфор открывали несколько раз. Причем всякий раз получали его из … мочи. Есть упоминания
- 5. Строение атома фосфора
- 6. период Фосфор как химический элемент III группа VА валентных электронов 5 степени окисления -3, +3, +5
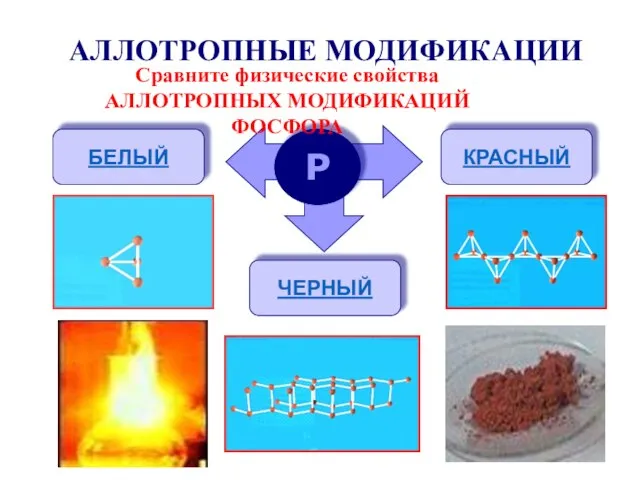
- 7. АЛЛОТРОПНЫЕ МОДИФИКАЦИИ Р БЕЛЫЙ КРАСНЫЙ ЧЕРНЫЙ Сравните физические свойства АЛЛОТРОПНЫХ МОДИФИКАЦИЙ ФОСФОРА
- 8. Наиболее распространённые модификации: красный и белый (жёлтый)
- 9. Молекулы P4 имеют форму тетраэдра. Это легкоплавкое t(пл)=44,1оС, t(кип)=275оС, мягкое, бесцветное воскообразное вещество. Хорошо растворяется в
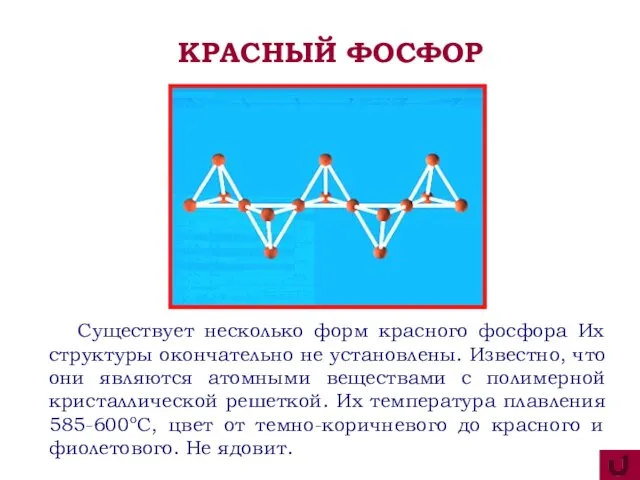
- 10. Существует несколько форм красного фосфора Их структуры окончательно не установлены. Известно, что они являются атомными веществами
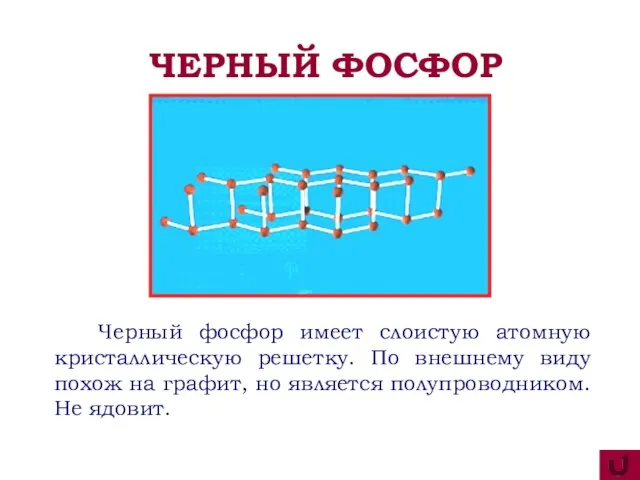
- 11. Черный фосфор имеет слоистую атомную кристаллическую решетку. По внешнему виду похож на графит, но является полупроводником.
- 13. 1.С металлами: 3Ca + 2P= Ca3 P2 фосфид кальция 2.C неметаллами: 4P + 5O2 =2P 2
- 14. 3. с бертолетовой солью при ударе взрывается, воспламеняется: KClO3 + P = P2O5 + KCl
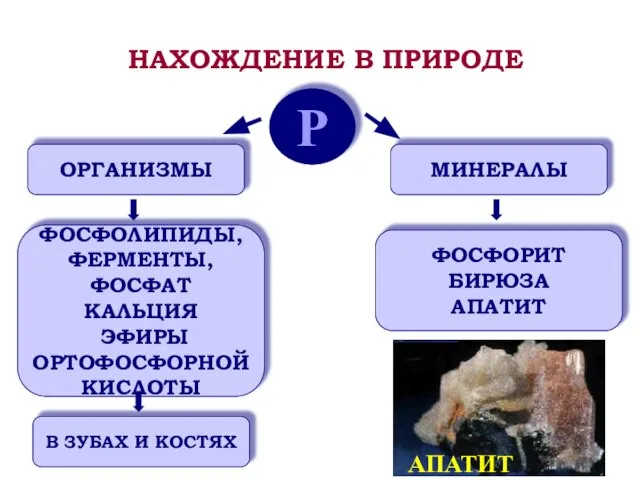
- 15. Р ОРГАНИЗМЫ МИНЕРАЛЫ ФОСФОЛИПИДЫ, ФЕРМЕНТЫ, ФОСФАТ КАЛЬЦИЯ ЭФИРЫ ОРТОФОСФОРНОЙ КИСЛОТЫ В ЗУБАХ И КОСТЯХ ФОСФОРИТ БИРЮЗА
- 16. Физиологическое действие белого фосфора Результат применения чрезмерного количества фосфора Появление лягушек с уродствами -результат применения фосфорных
- 17. Получение фосфора нагреванием смеси фосфорита, угля и песка в электропечи: Ca3(PO4)2 + C + SiO2 →
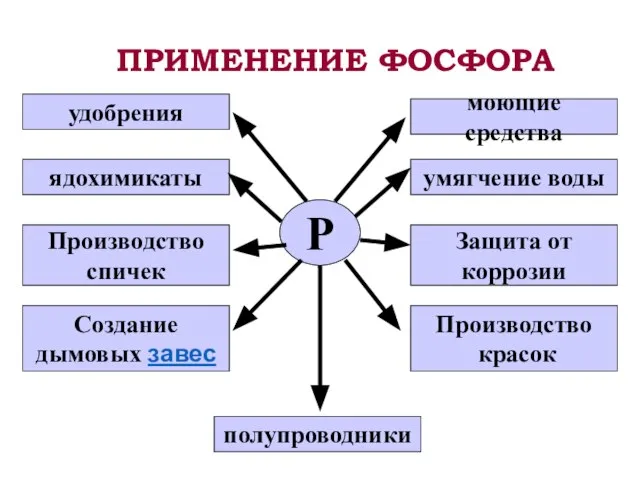
- 18. ПРИМЕНЕНИЕ ФОСФОРА Р удобрения ядохимикаты Производство спичек Создание дымовых завес полупроводники Производство красок Защита от коррозии
- 19. Биологическая роль фосфора Суточная потребность для взрослого человека 1 грамм Входит в состав скелета Входит в
- 20. Реакция организма на недостаток и избыток фосфора Недостаток Р Развивается заболевание рахит, снижается умственная и мышечная
- 25. Войска США использовали фосфорные Бомбы в Ираке, 2004 г.
- 26. ДОМАШНЕЕ ЗАДАНИЕ §21(Г.Е.Рудзитис) Индивидуальные задания. Подготовить сообщения: 1) об истории спичек; 2) о биологической роли фосфора
- 28. Скачать презентацию




















 Предмет химии. Вещества и их свойства
Предмет химии. Вещества и их свойства Водород. Вода
Водород. Вода Алканы – строение, химические свойства
Алканы – строение, химические свойства Общие физические и химические свойства металлов. 9 класс
Общие физические и химические свойства металлов. 9 класс Практическая работа №1. Определение содержания нитратов в овощах и фруктах
Практическая работа №1. Определение содержания нитратов в овощах и фруктах Цезий
Цезий Интеллектуальная игра по химии «Металлы»
Интеллектуальная игра по химии «Металлы» Амины. Классификация аминов
Амины. Классификация аминов Презентация по Химии "Химическая номенклатура и филология"
Презентация по Химии "Химическая номенклатура и филология"  Неорганическая и органическая химия
Неорганическая и органическая химия Презентация на тему Химический состав клетки. Неорганические соединения
Презентация на тему Химический состав клетки. Неорганические соединения  Исследование коррозии и создание антикоррозийного состава
Исследование коррозии и создание антикоррозийного состава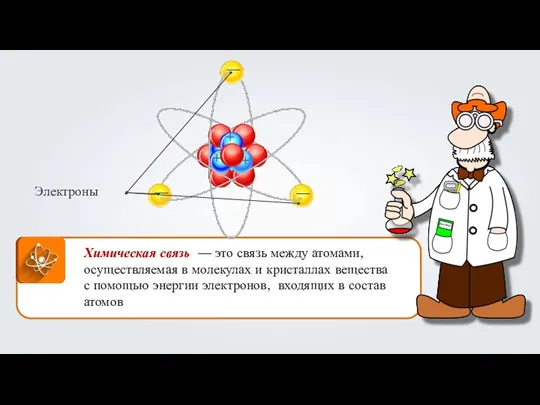 Ковалентная неполярная химическая связь
Ковалентная неполярная химическая связь Презентация на тему Всё о кремнии
Презентация на тему Всё о кремнии  Общая характеристика аргона
Общая характеристика аргона Углеводороды: изомерия
Углеводороды: изомерия Предмет органической химии. Строение атома углерода
Предмет органической химии. Строение атома углерода Презентация на тему Применение солей в быту
Презентация на тему Применение солей в быту  Автомобильное дизельное топливо
Автомобильное дизельное топливо Легкоплавкие сплавы. Изменение свойств сплавов на технологических этапах. Адгезия
Легкоплавкие сплавы. Изменение свойств сплавов на технологических этапах. Адгезия Коррозия металлов. Экзаменационные вопросы
Коррозия металлов. Экзаменационные вопросы Основания. 8 класс
Основания. 8 класс Презентация на тему Уголь
Презентация на тему Уголь  Сера и ее соединения
Сера и ее соединения Реакции ионного обмена составление ионных уравнений
Реакции ионного обмена составление ионных уравнений Гальванические элементы
Гальванические элементы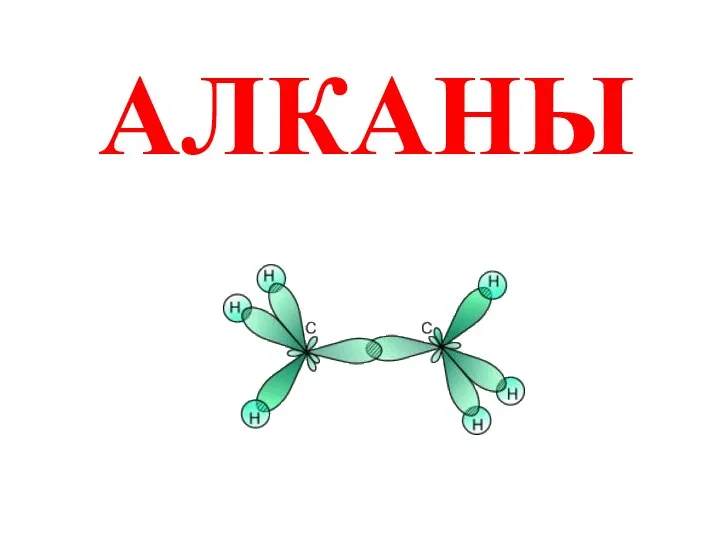 Алканы
Алканы Пероксид щелочных металлов
Пероксид щелочных металлов