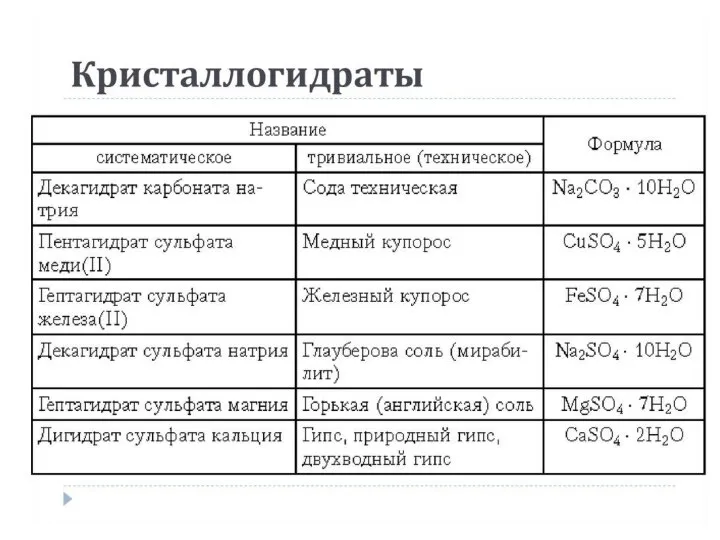
Слайд 7Кристаллогидраты – соли, содержащие связанную воду

Слайд 9Задания ЕГЭ по классификации неорганических веществ (№5) 1 балл
Вывод – учим тривиальные

названия веществ!
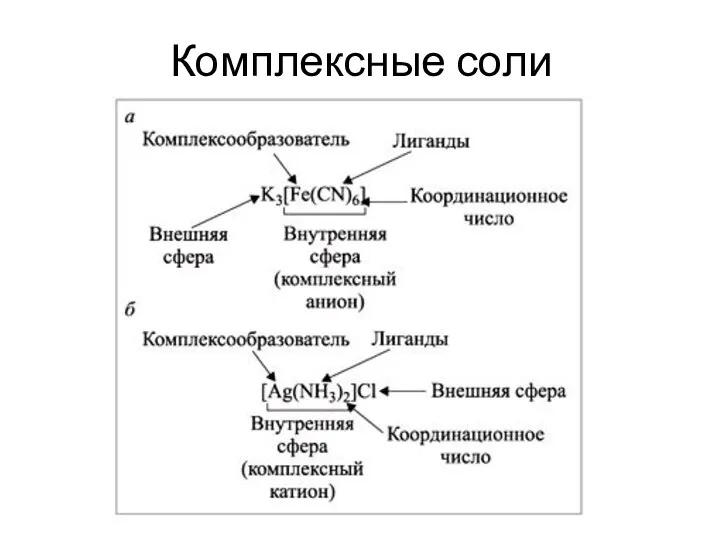
Слайд 15Химические свойства комплексных соединений
В растворе комплексные соединения ведут себя как сильные электролиты,

т.е. полностью диссоциируют на катионы и анионы:
[Pt(NH3)4]Cl2 = Pt(NH3)4]2+ + 2Cl–,
K2[PtCl4] = 2K+ + [PtCl4]2–.
Диссоциация по такому типу называется первичной.
Вторичная диссоциация связана с удалением лигандов из внутренней сферы комплексного иона:
[PtCl4]2– PtCl3– + Cl–.
Вторичная диссоциация происходит ступенчато: комплексные ионы ([PtCl4]2–) являются слабыми электролитами.
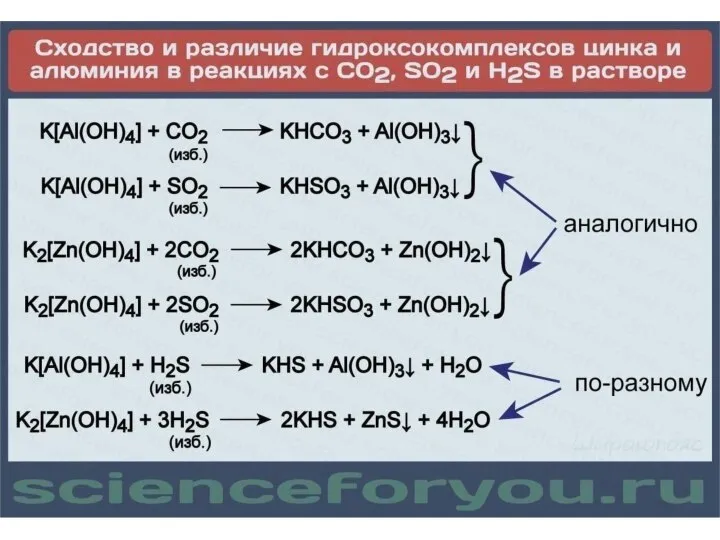
Слайд 162. При действии сильных кислот происходит разрушение гидроксокомплексов, например:
а) при недостатке кислоты
Na3[Al(OH)6] +

3HCl = 3NaCl + Al(OH)3 + 3H2O;
б) при избытке кислоты
Na3[Al(OH)6] + 6HCl = 3NaCl + AlCl3 + 6H2O.
3. Нагревание (термолиз) всех аммиакатов приводит к их разложению, например:
[Cu(NH3)4]SO4 CuSO4 + 4NH3.
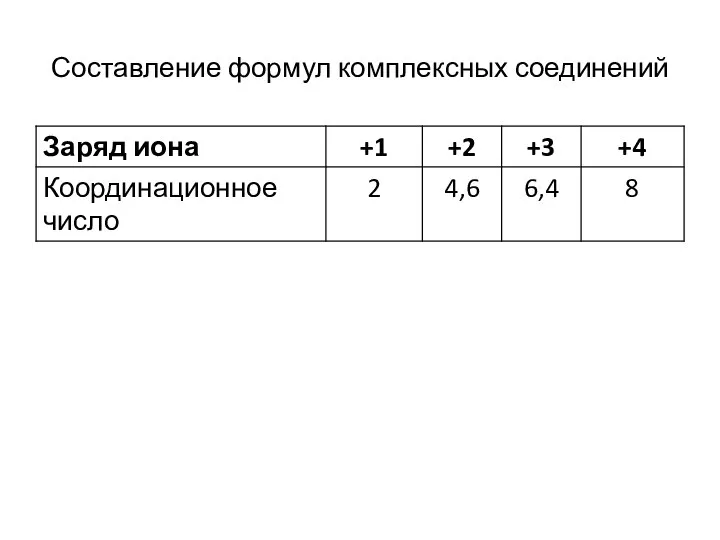
Слайд 17Составление формул комплексных соединений
Слайд 19Примеры заданий ЕГЭ № 32 (4 балла)
Медь растворили в разбавленной азотной кислоте.

К полученному раствору добавили избыток раствора аммиака, наблюдая сначала образование осадка, а затем — его полное растворение с образованием тёмно-синего раствора. Полученный раствор обработали серной кислотой до появления характерной голубой окраски солей меди. Запишите уравнения описанных реакций.
Слайд 20К раствору гидроксида натрия добавили порошок алюминия. Через раствор полученного вещества пропустили

избыток углекислого газа. Выпавший осадок отделили и прокалили. Полученный продукт сплавили с карбонатом натрия.










 Характеристика кислорода и серы
Характеристика кислорода и серы Скорость химической реакции и химическое равновесие
Скорость химической реакции и химическое равновесие Алкины. Способы получения
Алкины. Способы получения Химический состав молока
Химический состав молока Исследование физико-химических свойств растворов сахарозы
Исследование физико-химических свойств растворов сахарозы Закон сохранения массы веществ. Уравнения химических реакций.
Закон сохранения массы веществ. Уравнения химических реакций. Nxf_uZGQ8YFvfhQYo-sHuA
Nxf_uZGQ8YFvfhQYo-sHuA Презентация на тему Галогены в организме человека
Презентация на тему Галогены в организме человека  Удельная теплота сгорания
Удельная теплота сгорания Химический алфавит. Алфавит
Химический алфавит. Алфавит Простые вещества – неметаллы
Простые вещества – неметаллы Химия на войне
Химия на войне Презентация на тему Углекислый газ CO2
Презентация на тему Углекислый газ CO2  Дисперсные системы
Дисперсные системы Степень окисления серы
Степень окисления серы Klas_kh_r_-ur_-urok1
Klas_kh_r_-ur_-urok1 Гидролиз солей
Гидролиз солей Окисление и восстановление
Окисление и восстановление Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Общие химические свойства неметаллов. Урок в 10 классе
Общие химические свойства неметаллов. Урок в 10 классе Азотная кислота
Азотная кислота Алициклические и гетероциклические соединения. Тема № 7, 8
Алициклические и гетероциклические соединения. Тема № 7, 8 Кислоты. Начальные сведения
Кислоты. Начальные сведения Производство концентрированной азотной кислоты (лекция 15)
Производство концентрированной азотной кислоты (лекция 15) Химия и производство
Химия и производство Эксперимент Осадки и растворы
Эксперимент Осадки и растворы Электролиз (катод)
Электролиз (катод) Дорогие и дешёвые лекарства: Чем похожи и чем отличаются друг от друга?
Дорогие и дешёвые лекарства: Чем похожи и чем отличаются друг от друга?