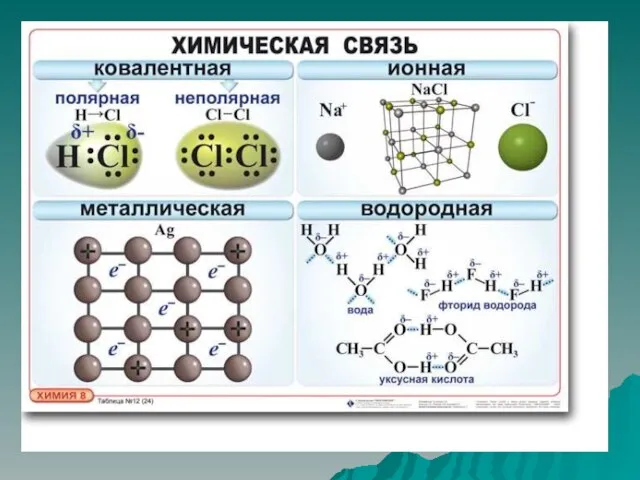
Слайд 2Химическая связь
– это вид взаимодействия, при котором происходит перераспределение электронов между атомами.

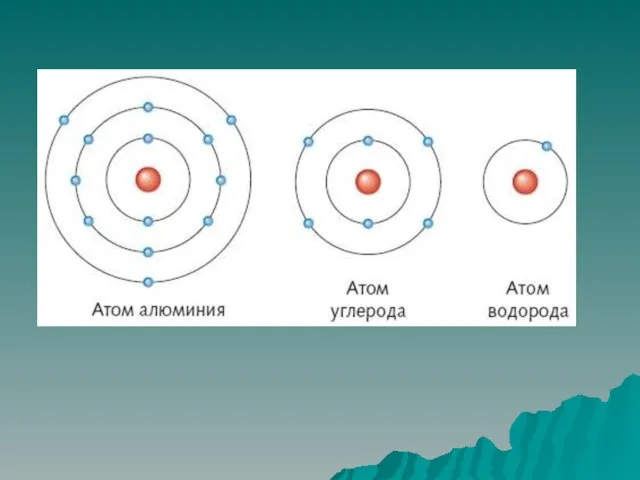
Слайд 5Если число электронов на внешнем уровне атома максимальное, то такой уровень называется

завершенным.
такие атомы не вступают в химической взаимодействие при обычных условиях. Это благородные элементы – 8 главная подгруппа.
Внешний уровень других атомов незавершенным. Они стремятся довести его до 8-электронного.
Электроны внешнего энергетического уровня являются валентными
При взаимодействии этих электронов образуется химическая связь.
В молекуле электроны становятся общими.
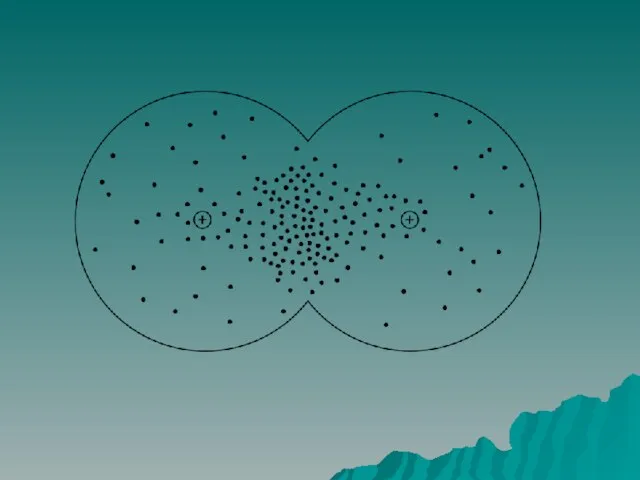
Слайд 6Ковалентная связь
Ковалентная связь – это тип химической связи между двумя атомами, возникающий

при обобществлении электронов, которые принадлежат этим атомам
Образуются общие электронные пары.
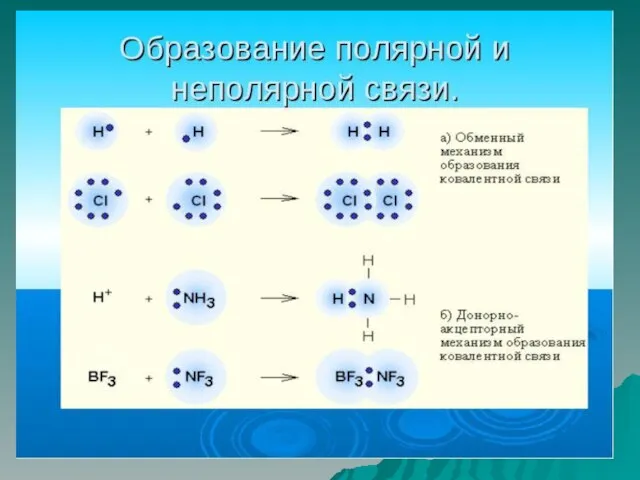
Слайд 8Метод валентных схем
Ковалентная вязь образуется между двумя атомами за счет перекрывания одноэлектронных

валентных облаков (обменный механизм) или перекрывания двухэлектронных валентных облаков и вакантных облаков (донорно-акцепторный механизм)
Слайд 11Характеристики ковалентной связи
Энергия связи – эта та энергия, которую необходимо затратить для

разрыва данной связи. Измеряется в кДж/моль
Зависит от радиуса перекрывающихся облаков.
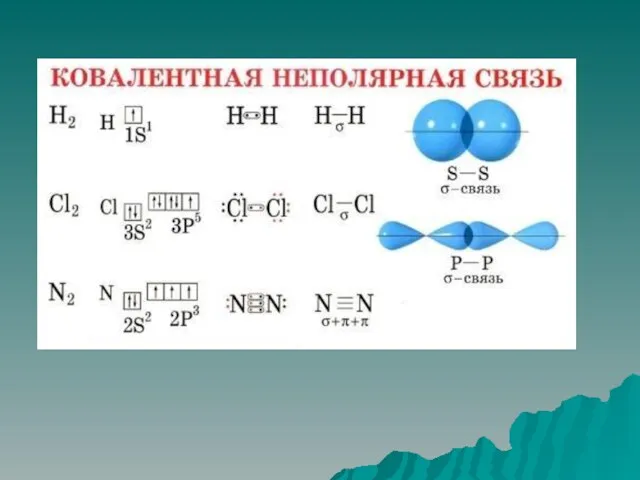
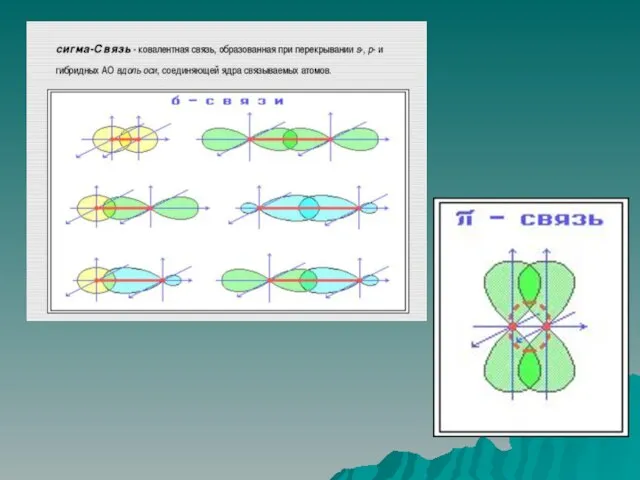
Слайд 14Способ перекрывания электронных облаков
σ - связь образуется при перекрывании вдоль линии, соединяющей

центры атомов. Более прочная.
π – связь образуется при боковом перекрывании в двух областях пространства. Между р-орбиталями
Слайд 16Кратность связи – число химических связей между двумя атомами
Ее можно показать сплошной

линией между атомами либо – точками –
Чем больше кратность связи, тем прочнее связь
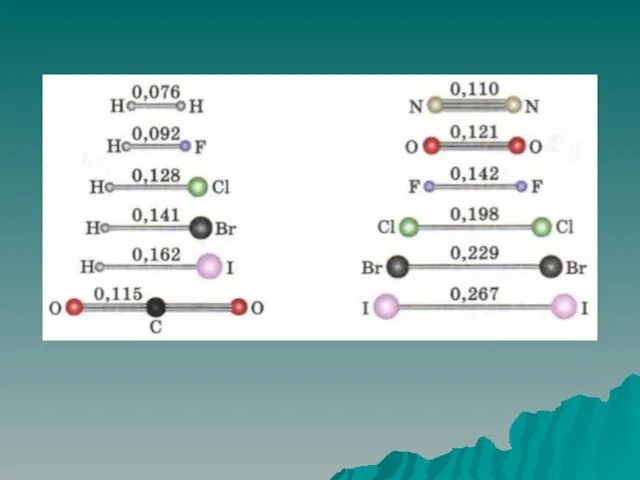
Слайд 18Длина связи – расстояние между ядрами атомов в молекуле.
зависит:
радиусов атома НF, HCl,

HBr, HJ
от кратности связи
Чем больше кратность связи и меньше радиус атомов, тем сильнее химическая связь, ее энергия.
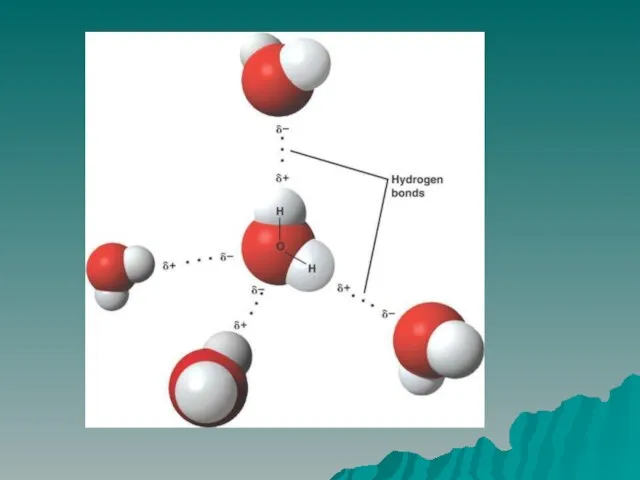
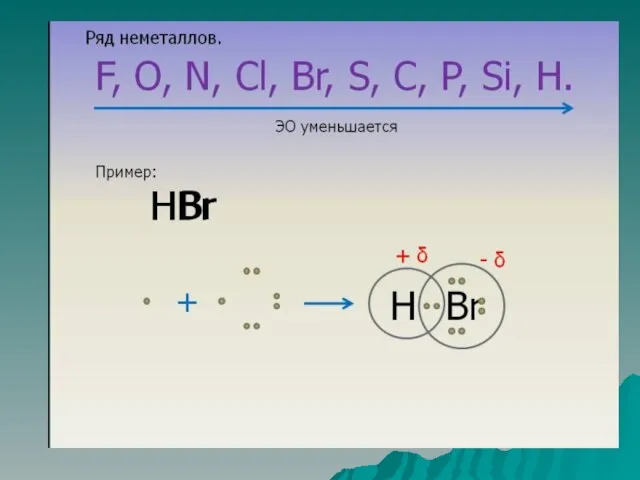
Слайд 20Полярность связи – смещение общей электронной плотность к более электроотрицательному атому.
В зависимости

от этого ковалентная связь делится на полярную и неполярную.
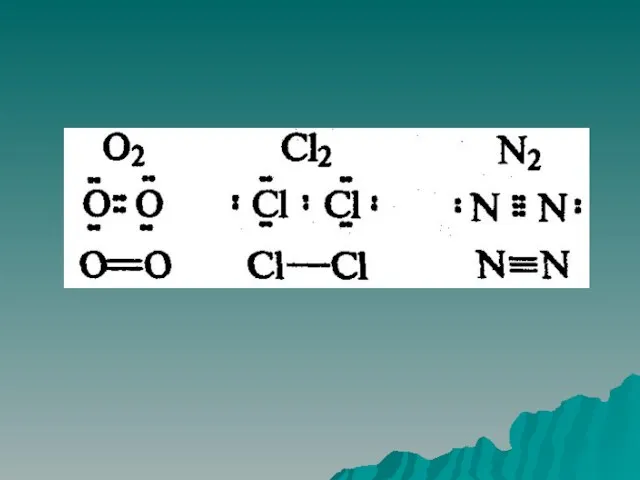
Слайд 23Неполярная ковалентная связь –электронная плотность между атомами распределяется равномерно. К ней относятся

двухатомные молекулы, состоящие из одного элемента: кислород, азот, хлор и т.д.
Полярная ковалентная связь – электронное облако смещено к более электроотрицательному атому. Газы: HCl, H2O, NH3 и т.д.
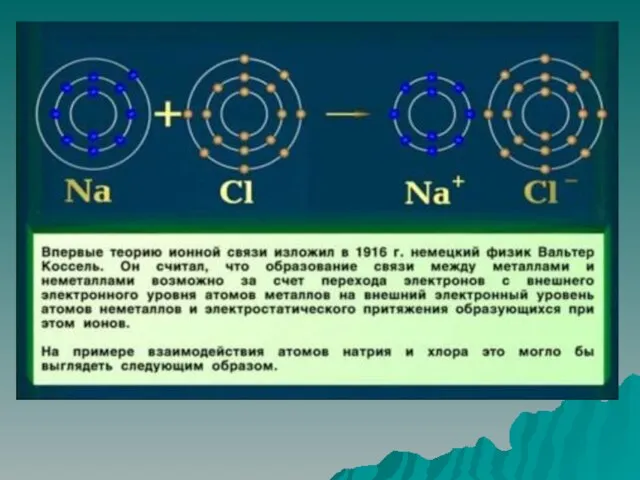
Слайд 25Степень окисления – это условный заряд, который приобретает элемент, исходя из того,

что связь чисто ионная
У элементов 1-3 группы в соединениях всегда положительная степень окисления.
У элементов 4-7 группы максимальная положительная степень окисления равна номеру группы, а промежуточные через единицу от максимальной.
Чем выше в группе находится элемент, тем характернее для него максимальная положительная степень окисления
У элементов 4-7 группы максимальная отрицательная степень окисления равна разности (8 - номеру группы), а промежуточные через единицу от максимальной.
S -2, 0, +2, +4, +6















 Plexiglas. Органическое стекло
Plexiglas. Органическое стекло Простые и сложные вещества (8 класс)
Простые и сложные вещества (8 класс) Лекция 3. Строение электронной оболочки атома (1)
Лекция 3. Строение электронной оболочки атома (1) Алюминий и его сплавы, их характеристика. Деформируемые сплавы алюминия. Деформируемые и литейные сплавы алюминия
Алюминий и его сплавы, их характеристика. Деформируемые сплавы алюминия. Деформируемые и литейные сплавы алюминия Амфотерность. Амфотерные соединения
Амфотерность. Амфотерные соединения Классификация сложных неорганических веществ. Оксиды
Классификация сложных неорганических веществ. Оксиды Применение эфиров в производстве автомобильных бензинов
Применение эфиров в производстве автомобильных бензинов Основные положения теории электролитической диссоциации
Основные положения теории электролитической диссоциации Определение химического эквивалента, эквивалентной и атомной массы металла
Определение химического эквивалента, эквивалентной и атомной массы металла Презентация на тему Закон постоянства состава
Презентация на тему Закон постоянства состава  Типы химических реакций. 8 класс
Типы химических реакций. 8 класс Презентация на тему Азотная кислота
Презентация на тему Азотная кислота  Презентация на тему Фуллерены и нанотрубки
Презентация на тему Фуллерены и нанотрубки  Этанол. Химические свойства этанола
Этанол. Химические свойства этанола Составление уравнений окислительно-восстановительных реакций
Составление уравнений окислительно-восстановительных реакций Менделеев Дмитрий Иванович
Менделеев Дмитрий Иванович Ca КАЛЬЦИЙ
Ca КАЛЬЦИЙ Перспективы использования микроволнового излучения в органической химии
Перспективы использования микроволнового излучения в органической химии Стехиометрические законы химии
Стехиометрические законы химии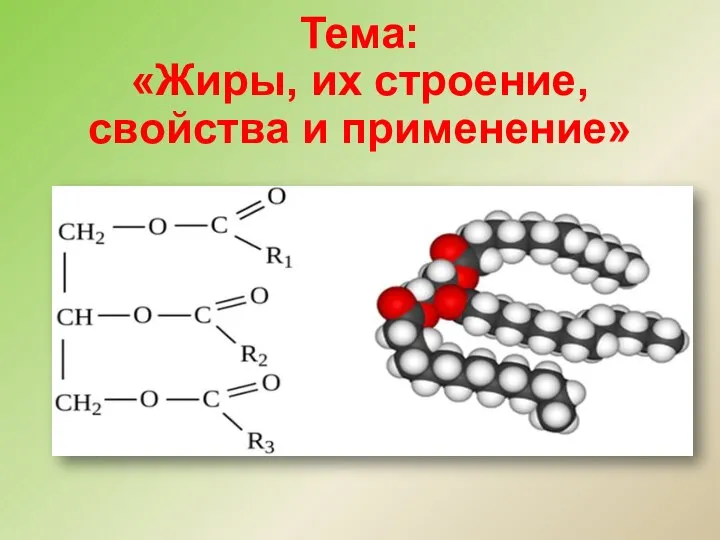 Жиры, их строение, свойства и применение
Жиры, их строение, свойства и применение Гидролиз. Виды гидролиза
Гидролиз. Виды гидролиза Нуклеиновые кислоты
Нуклеиновые кислоты Водород – первый элемент в периодической таблице
Водород – первый элемент в периодической таблице Массовая доля химич элемента
Массовая доля химич элемента Физико-химические свойства растворов ВМС
Физико-химические свойства растворов ВМС Химические свойства оснований
Химические свойства оснований Презентация на тему Основные классы неорганических соединений
Презентация на тему Основные классы неорганических соединений  Ковалентная связь
Ковалентная связь