Содержание
- 2. Химическая кинетика - учение о скорости химических реакций и зависимости ее от различных факторов - природы
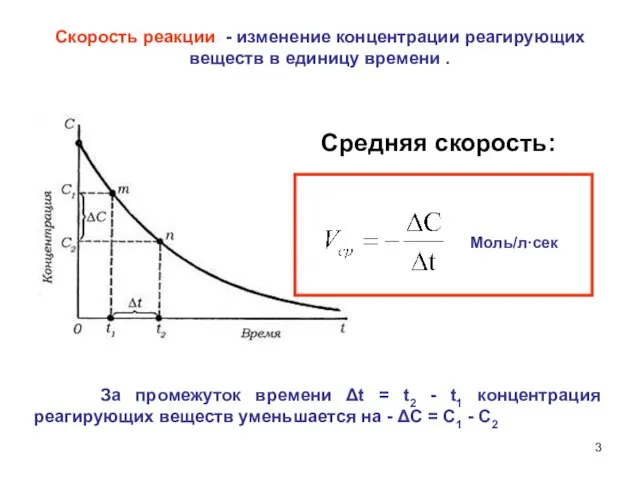
- 3. Скорость реакции - изменение концентрации реагирующих веществ в единицу времени . За промежуток времени Δt =
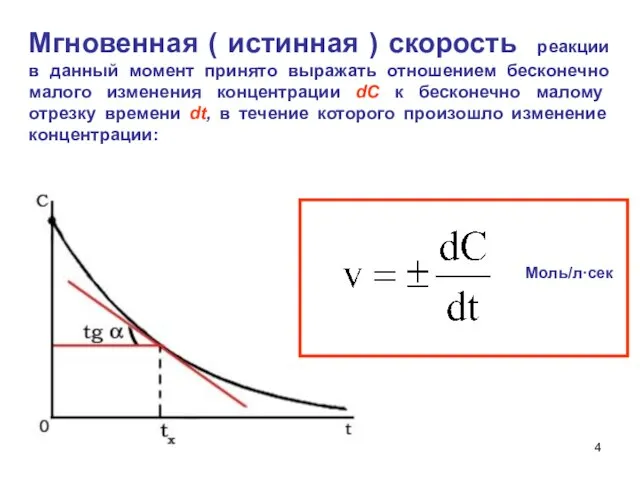
- 4. Мгновенная ( истинная ) скорость реакции в данный момент принято выражать отношением бесконечно малого изменения концентрации
- 5. Классификация химических реакций Молекулярность: Бимолекулярные - в элементарном акте взаимодействия встречаются две молекулы. Мономолекулярные - в
- 6. Одновременная встреча в элементарном акте трех молекул случается довольно редко. Тримолекулярные – в элементарном акте взаимодействия
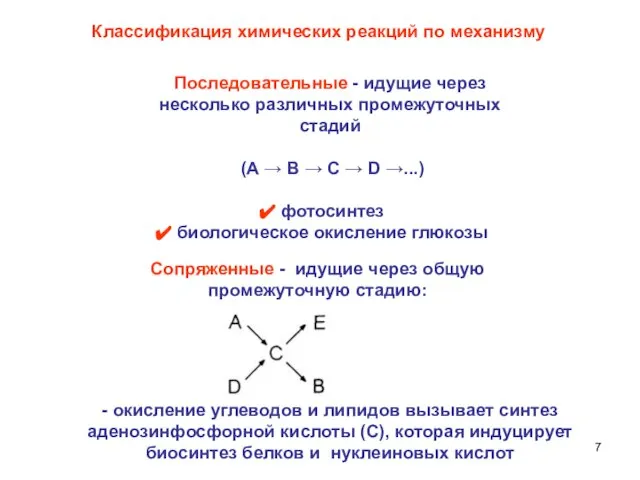
- 7. Сопряженные - идущие через общую промежуточную стадию: Классификация химических реакций по механизму Последовательные - идущие через
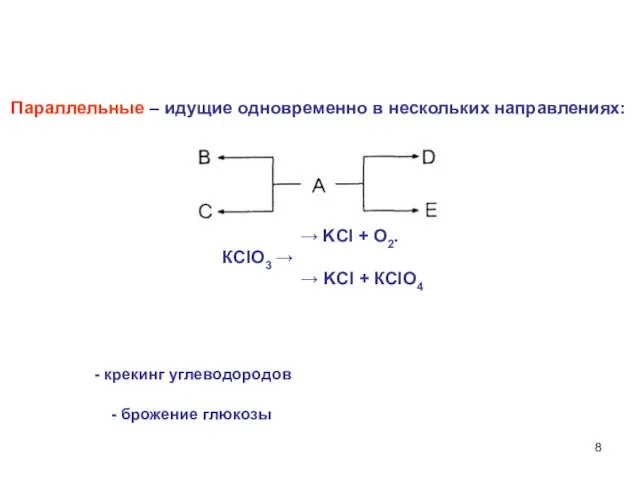
- 8. Параллельные – идущие одновременно в нескольких направлениях: → KCl + О2. КСlO3 → → KCl +
- 9. Цепные - стадии превращения исходных соединений в продукты многократно повторяются:
- 10. 2. Порядок реакции Порядок реакции - сумма показателей степеней, с которыми концентрации реагентов входят в экспериментально
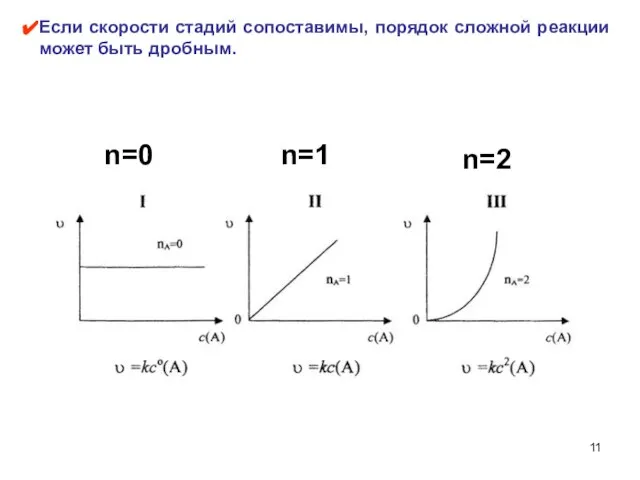
- 11. Если скорости стадий сопоставимы, порядок сложной реакции может быть дробным. n=0 n=1 n=2
- 12. ФАКТОРЫ, ВЛИЯЮЩИЕ НА СКОРОСТЬ ГОМОГЕННЫХ РЕАКЦИЙ природа реагирующих веществ концентрация реагентов температура катализатор
- 13. Реакции между молекулами протекают обычно медленно, между ионами и радикалами – быстро: Влияние природы реагирующих веществ
- 14. Влияние концентрации реагентов Чем выше концентрация, тем больше скорость реакции, что связано с увеличением числа эффективных
- 15. Закон действия масс (ЗДМ) Скорость гомогенной реакции при постоянной температуре пропорциональна произведению молярных концентраций реагирующих веществ,
- 16. k - константа скорости химической реакции (удельная скорость реакции) численно равна скорости химической реакции при концентрациях
- 17. Концентрации твердых веществ в гетерогенных системах не входят в выражение константы химического равновесия, так как они
- 18. Закон Вант-Гоффа При повышении температуры на 10° скорость химической реакции возрастает в два-четыре раза. Если повысить
- 19. E — энергия активации К — константа скорости реакции при обычных условиях Ао — число эффективных
- 20. Графический способ нахождения Ea и Ao из уравнения Аррениуса Математический способ нахождения Ea из уравнения Аррениуса
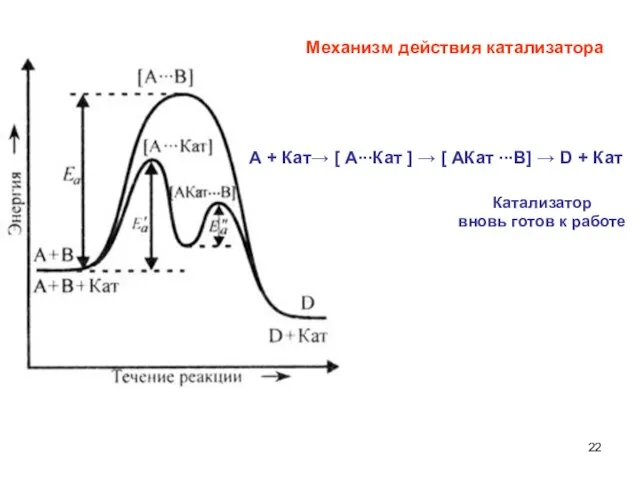
- 21. Катализаторы - вещества, увеличивающие скорость химических реакций Ингибиторы - вещества, замедляющие скорость химических реакций Влияние катализатора
- 22. Катализатор вновь готов к работе Механизм действия катализатора А + Кат→ [ А∙∙∙Кат ] → [
- 23. Ферменты (энзимы) – белковые молекулы, которые катализируют химические реакции в живых системах Отличия от химического катализа
- 24. 2. Высокая химическая специфичность. Каждый из ферментов действует лишь на строго определенную реакцию или группу реакций,
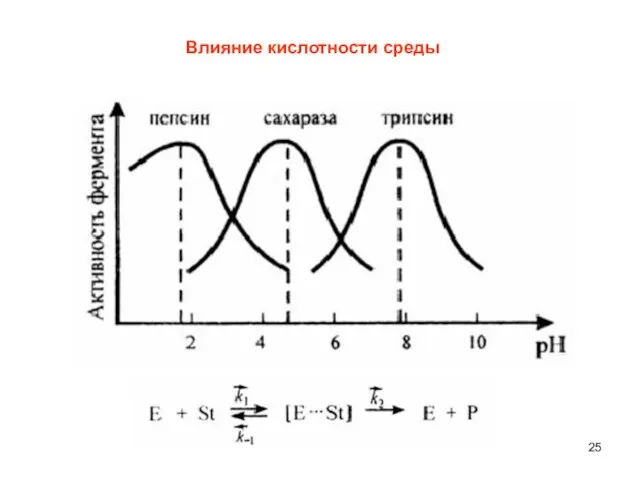
- 25. Влияние кислотности среды
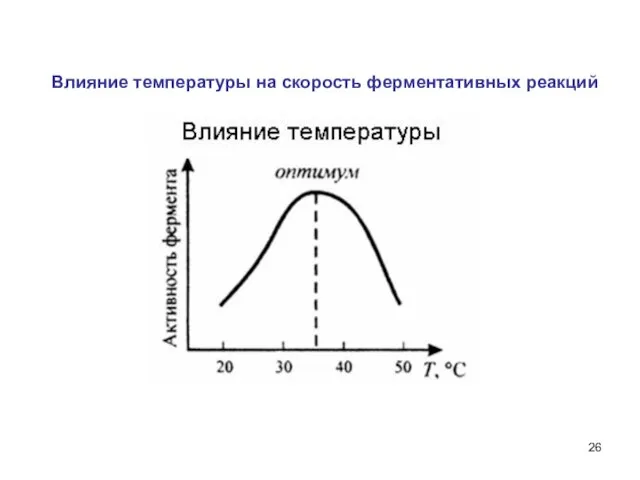
- 26. Влияние температуры на скорость ферментативных реакций
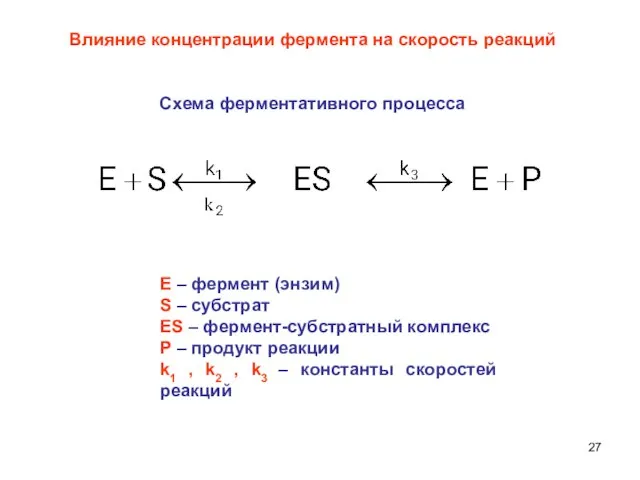
- 27. Влияние концентрации фермента на скорость реакций Схема ферментативного процесса Е – фермент (энзим) S – субстрат
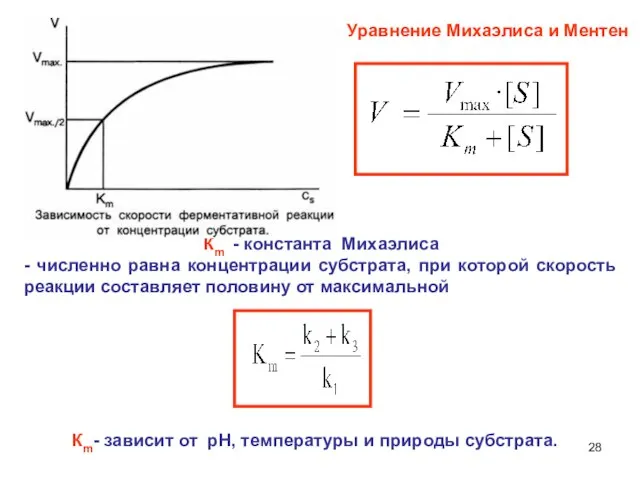
- 28. Кm - константа Михаэлиса - численно равна концентрации субстрата, при которой скорость реакции составляет половину от
- 29. При [ S ] При [ S ] >> Кm При [ S ] = Кm
- 30. Физический смысл константы Михаэлиса Константа Михаэлиса – Кm характеризует сродство фермента к субстрату! Высокое сродство достигается,
- 31. Значение ферментативных реакций Применение ферментов в качестве лекарственных препаратов; Разработка методов диагностики с помощью ферментов; Производство
- 32. Химическое равновесие
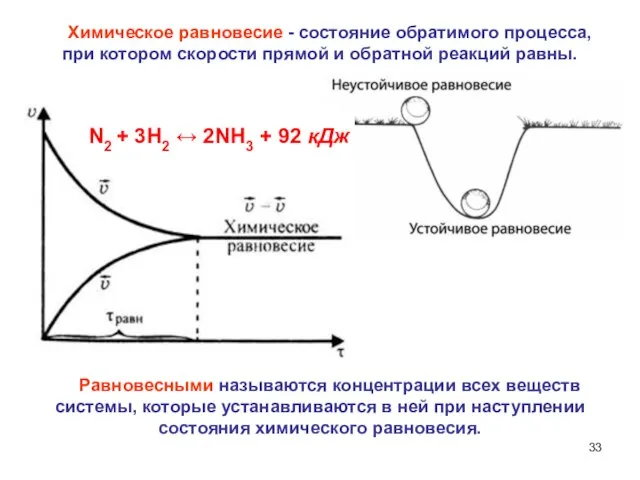
- 33. Химическое равновесие - состояние обратимого процесса, при котором скорости прямой и обратной реакций равны. Равновесными называются
- 34. Вывод константы химического равновесия В состоянии химического равновесия:
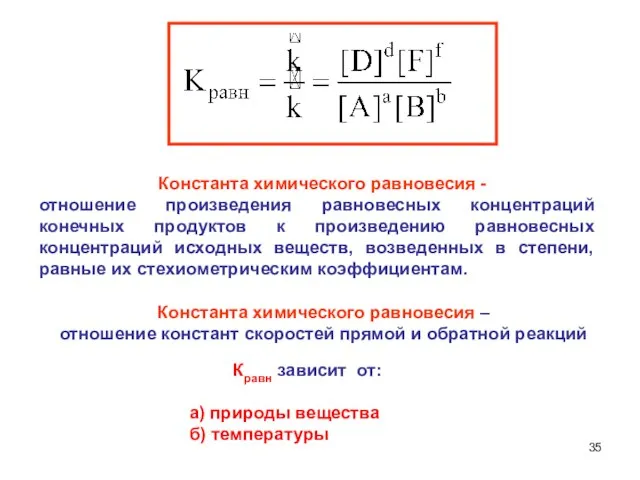
- 35. Константа химического равновесия - отношение произведения равновесных концентраций конечных продуктов к произведению равновесных концентраций исходных веществ,
- 36. Смещение химического равновесия. Принцип Ле Шателье Если на систему, находящуюся в состоянии равновесия оказывается внешнее воздействие,
- 37. 1. Влияние изменения температуры на смещение равновесия N2 + 3H2 ↔ 2NH3 + 92 кДж Экзотермическим
- 38. Со(Н2О)62+ + 4СI- ↔ СоСI42- + 6Н2О - Q розовый голубой Эндотермическим реакциям благоприятствует повышение температуры
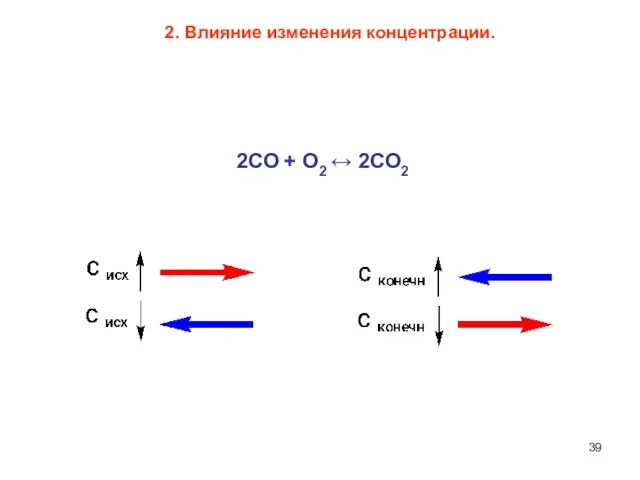
- 39. 2. Влияние изменения концентрации. 2СО + О2 ↔ 2СО2
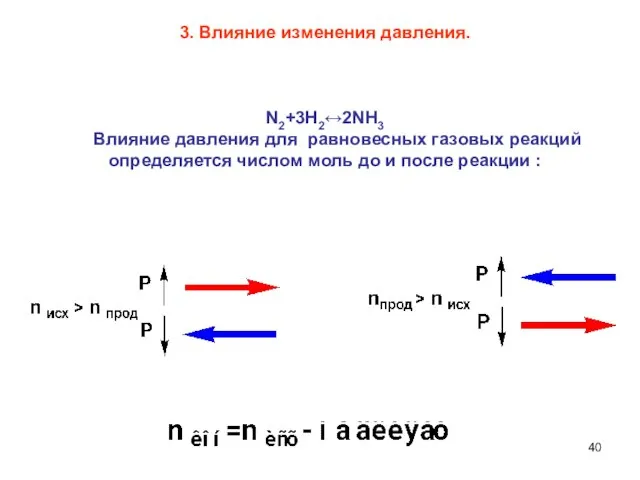
- 40. 3. Влияние изменения давления. N2+3H2↔2NH3 Влияние давления для равновесных газовых реакций определяется числом моль до и
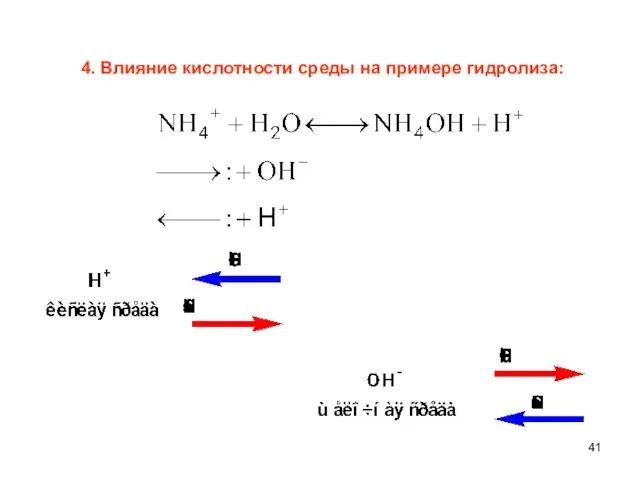
- 41. 4. Влияние кислотности среды на примере гидролиза:
- 43. Скачать презентацию

















![При [ S ] При [ S ] >> Кm При [](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/881154/slide-28.jpg)






 Фараонова Змея
Фараонова Змея Систематизация знаний по периодической системе химических элементов
Систематизация знаний по периодической системе химических элементов Доказательство амфотерности аминокислот. Продукты, содержащие аминокислоты и их соли
Доказательство амфотерности аминокислот. Продукты, содержащие аминокислоты и их соли Презентация на тему Химия в разных науках
Презентация на тему Химия в разных науках  Неорганические молекулы живого вещества: вода; химические свойства и биологическая роль
Неорганические молекулы живого вещества: вода; химические свойства и биологическая роль Типы химических реакций. 8 класс
Типы химических реакций. 8 класс Фенол. Понятие о фенолах
Фенол. Понятие о фенолах Исследование свойств многоатомных спиртов
Исследование свойств многоатомных спиртов Рефолдинг миниантител
Рефолдинг миниантител Презентация на тему Электролитическая диссоциация (8 класс)
Презентация на тему Электролитическая диссоциация (8 класс)  Комплексные соединения
Комплексные соединения Развитие ассоциативного мышления на уроках химии
Развитие ассоциативного мышления на уроках химии Презентация на тему Валентные состояния атома углерода
Презентация на тему Валентные состояния атома углерода  Медь
Медь Презентация по Химии "Белки как основа всего живого"
Презентация по Химии "Белки как основа всего живого"  Техника безопасности при использовании различных видов топлива. Практическая работа № 3
Техника безопасности при использовании различных видов топлива. Практическая работа № 3 Предмет органической химии. Урок №1
Предмет органической химии. Урок №1 Удельная теплота сгорания
Удельная теплота сгорания Окислительно- восстановительные реакции в органической химии. Подготовка к ЕГЭ
Окислительно- восстановительные реакции в органической химии. Подготовка к ЕГЭ Презентация на тему Неорганические кислоты
Презентация на тему Неорганические кислоты  Выберите вещества
Выберите вещества Автомобильное дизельное топливо
Автомобильное дизельное топливо Чистячі засоби для ванної кімнати та кафелю
Чистячі засоби для ванної кімнати та кафелю Презентация на тему Элементы главной подгруппы V группы
Презентация на тему Элементы главной подгруппы V группы  Элементарный, химический и фракционный состав нефти, газа и конденсата
Элементарный, химический и фракционный состав нефти, газа и конденсата Химические уравнения
Химические уравнения Вчення про розчини. Колігативні властивості розчинів
Вчення про розчини. Колігативні властивості розчинів Пластмассы и их свойства
Пластмассы и их свойства