Содержание
- 2. Физические свойства алкинов С2 – С4 газы С5 – С 15 жидкости Свыше С16 – твердые
- 3. Химические свойства алкинов 1. Реакции присоединения АЕ Н.Б.Давыдова, учитель химии МБОУ "Вадская СОШ"
- 4. Химические свойства алкинов 1. Реакции присоединения АЕ а) Гидрирование(+Н2) в 2 стадии: Н.Б.Давыдова, учитель химии МБОУ
- 5. 1. Реакции присоединения АЕ б) Галогенирование (+Г2) в 2 стадии: Качественная реакция на алкины – бромная
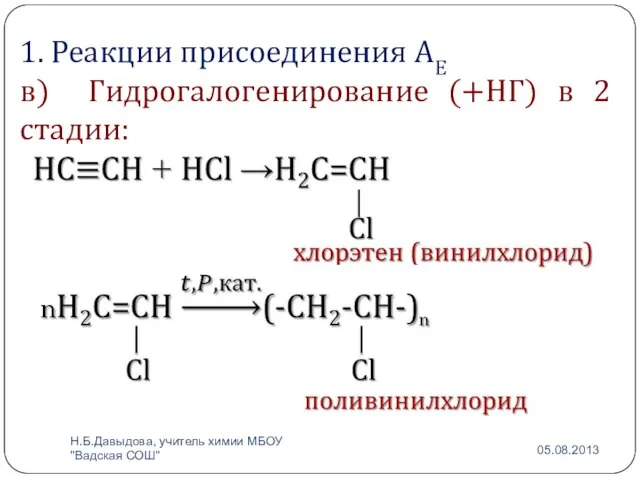
- 6. 1. Реакции присоединения АЕ в) Гидрогалогенирование (+НГ) в 2 стадии: Н.Б.Давыдова, учитель химии МБОУ "Вадская СОШ"
- 7. Применение поливинилхлорида: Изоляция для проводов, изоляционная лента, искусственная кожа, плащи, кленка. Н.Б.Давыдова, учитель химии МБОУ "Вадская
- 8. Присоединение НГ к несимметричным алкинам (по правилу Марковникова) МАРКОВНИКОВ Владимир Васильевич Н.Б.Давыдова, учитель химии МБОУ "Вадская
- 9. МАРКОВНИКОВ Владимир Васильевич (13 декабря 1837—29 января 1904) — русский химик, основатель научной школы. Развивая теорию
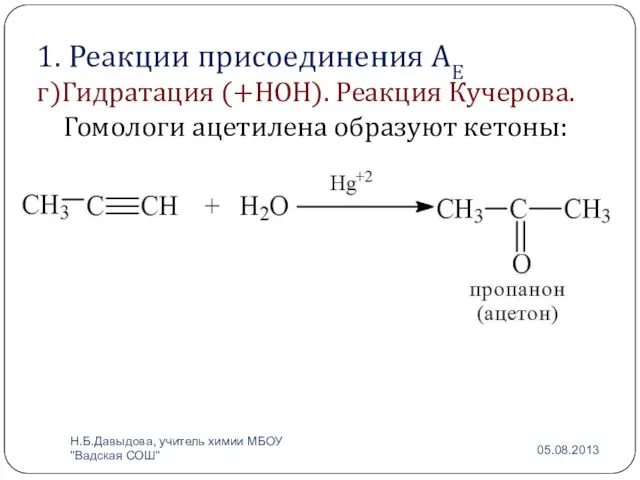
- 10. 1. Реакции присоединения АЕ г)Гидратация (+НОН). Реакция Кучерова. КУЧЕРОВ Михаил Григорьевич Правило Эльтекова: Спирты, содержащие гидроксо-группу
- 11. КУЧЕРОВ Михаил Григорьевич (3 июня1850 – 26 июня 1911). Русский химик-органик. Основные работы посвящены развитию органического
- 12. 1. Реакции присоединения АЕ г)Гидратация (+НОН). Реакция Кучерова. Гомологи ацетилена образуют кетоны: Н.Б.Давыдова, учитель химии МБОУ
- 13. Опыт. Горение ацетилена Ацетилен образует с воздухом и кислородом взрывоопасные смеси. Опыт . Взрыв смеси ацетилена
- 14. 2. Реакции окисления. а) Окисление раствором водным раствором перманганата калия (качественная реакция). В нейтральной и слабощелочной
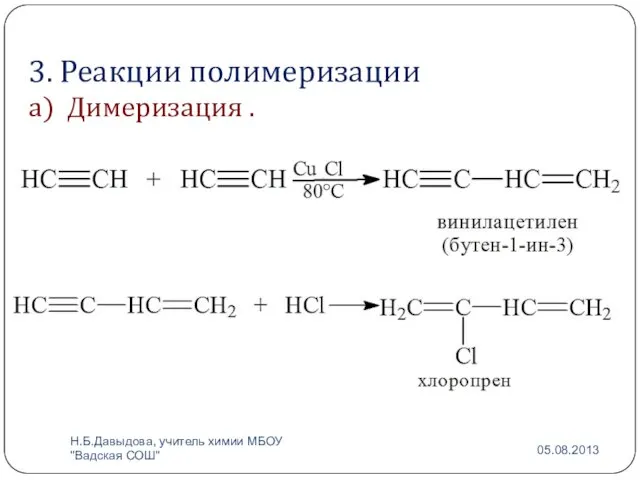
- 15. 3. Реакции полимеризации а) Димеризация . Н.Б.Давыдова, учитель химии МБОУ "Вадская СОШ"
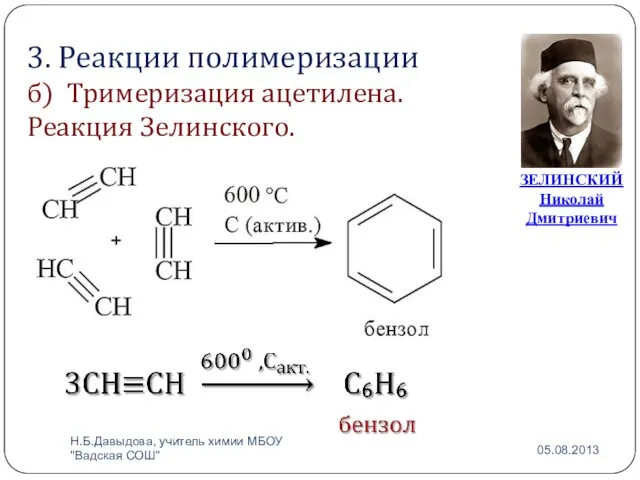
- 16. 3. Реакции полимеризации б) Тримеризация ацетилена. Реакция Зелинского. ЗЕЛИНСКИЙ Николай Дмитриевич Н.Б.Давыдова, учитель химии МБОУ "Вадская
- 17. Николай Дмитриевич Зелинский (25 января 1861 — 31 июля 1953) — замечательный русский химик, основоположник учения
- 18. 4. Реакции замещения (кислотные свойства) HC≡CH + Ag2O → AgC≡CAg↓+ H2O амм. р-р ацетиленид серебра, белый
- 19. ТРЕНАЖЁРЫ: Закрепление материала Типы химических реакций, характерные для алкинов Уравнения реакций, характеризующие химические свойства ацетилена Химические
- 20. ПОДГОТОВКА К ЕГЭ: Закрепление материала Базовый уровень сложности 1. При гидратации ацетилена образуется 1) этанол 2)
- 21. ПОДГОТОВКА К ЕГЭ: Базовый уровень сложности 5. Пропин можно отличить от пропена с помощью 1) водного
- 22. Повышенный уровень сложности 8. Бутин-1 способен реагировать с 1) натрием 4) кислородом 2) гидроксидом натрия 5)
- 23. Домашнее задание: Учебник: Кузнецова Н.Е., Гара Н.Н. Титова И.М.; под ред. Н. Е. Кузнецовой. Химия: профильный
- 25. Скачать презентацию


















 Кальций, железо. Горение стальной ваты и железного порошка
Кальций, железо. Горение стальной ваты и железного порошка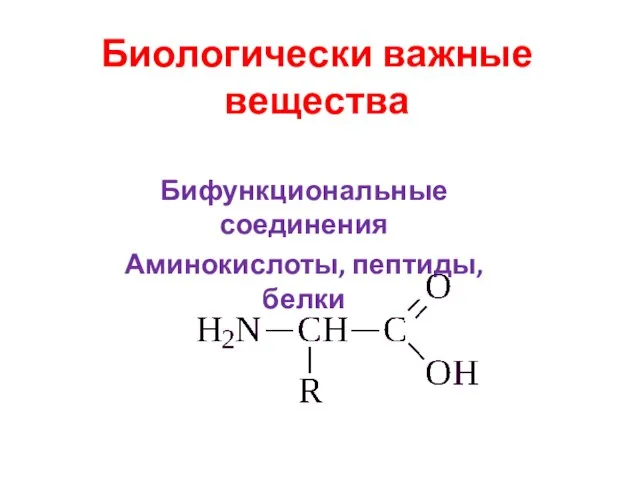 Биологически важные вещества. Бифункциональные соединения. Аминокислоты, пептиды, белки
Биологически важные вещества. Бифункциональные соединения. Аминокислоты, пептиды, белки Основания как электролиты
Основания как электролиты Химические свойства кислот с точки зрения ТЭД
Химические свойства кислот с точки зрения ТЭД Химический анализ
Химический анализ Презентация на тему Генетическая связь между классами неорганических вещ-в
Презентация на тему Генетическая связь между классами неорганических вещ-в  Термодинамика живого объекта. Основы биоэнергетики. Лекция 2
Термодинамика живого объекта. Основы биоэнергетики. Лекция 2 Презентация на тему Типы изомерии
Презентация на тему Типы изомерии  Закон сохранения массы веществ
Закон сохранения массы веществ Энергетический обмен
Энергетический обмен Исследование фазовых и структурных превращений в железе и его сплавах магнитным методом
Исследование фазовых и структурных превращений в железе и его сплавах магнитным методом Водород в природе. Получение водорода и его физические свойства. 8 класс
Водород в природе. Получение водорода и его физические свойства. 8 класс Железо и его соединения. Строение атома железа
Железо и его соединения. Строение атома железа Неорганические вещества
Неорганические вещества Галогенпроизводные алканов. Методы получения
Галогенпроизводные алканов. Методы получения Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Гидроксикарбоновые кислоты
Гидроксикарбоновые кислоты Изучение адсорбции аминокислот на поверхности гидроксилапатита при варьировании рН
Изучение адсорбции аминокислот на поверхности гидроксилапатита при варьировании рН Турнир Деда Мороза. Викторина по химии
Турнир Деда Мороза. Викторина по химии Классификация сложных неорганических веществ. Оксиды
Классификация сложных неорганических веществ. Оксиды Очистка поваренной соли методом кристаллизации в домашних условиях
Очистка поваренной соли методом кристаллизации в домашних условиях Свойства алмаза
Свойства алмаза Неметаллы. Агрегатные состояния неметаллов
Неметаллы. Агрегатные состояния неметаллов Изучение пенопласта
Изучение пенопласта Презентация по химии на тему _Высокомолекулярные Соединения_ (1)
Презентация по химии на тему _Высокомолекулярные Соединения_ (1) Интерактивная интеллектуальная игра. Юный химик
Интерактивная интеллектуальная игра. Юный химик Схема реакций
Схема реакций Путешествие в мир кислот
Путешествие в мир кислот