Содержание
- 2. Виды простых чистящих веществ Ежедневно приходится пользоваться хозяйственным и туалетным мылом, не подозревая даже при этом,
- 3. Пальмитиновая кислота
- 4. Другой пример использования знаний по химии в прикладной плоскости — использование раствора соляной кислоты для очистки
- 5. Химия в кулинарии Какие блюда можно приготовить, имея знания по практической химии? Наиболее распространенный «домашний» пример
- 6. Обеззараживание ядовитых соединений Мало кто знает, что самый надежный способ борьбы с последствиями разбитых ртутных термометров
- 7. Образование накипи в чайнике В бытовых условиях нет химически чистой воды, в ней всегда в различной
- 9. Скачать презентацию
Слайд 2Виды простых чистящих веществ
Ежедневно приходится пользоваться хозяйственным и туалетным мылом, не подозревая даже
Виды простых чистящих веществ
Ежедневно приходится пользоваться хозяйственным и туалетным мылом, не подозревая даже

Создание происходит просто — путем проведения реакции гидроксида натрия и кислоты с длинной цепочкой (естественно, в этом случае речь идет о хозяйственном мыле, ведь для изготовления мыла туалетного используется большое количество ароматизаторов). Механизм действия этих веществ объясняется следующим: благодаря физическим особенностям молекул (биполярность) эти соединения проявляют липофильные свойства. Благодаря этому рассматриваемые соединения способны притягивать молекулы жира и таким образом очищать загрязненные поверхности.
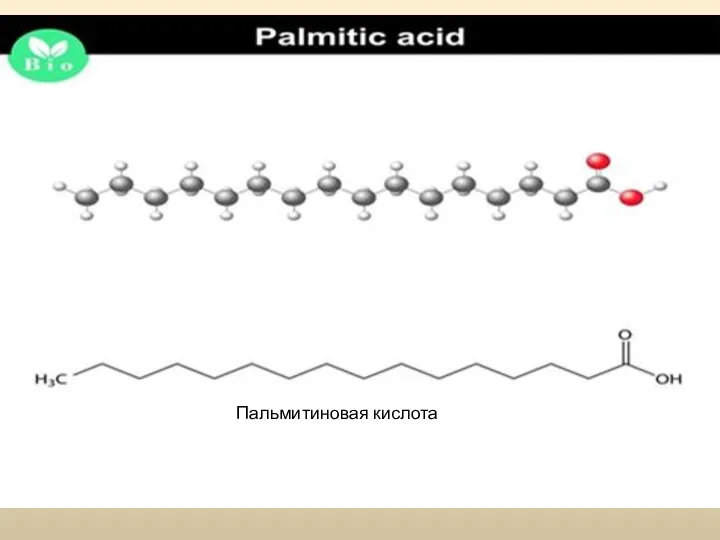
Слайд 3Пальмитиновая кислота
Пальмитиновая кислота
Слайд 4Другой пример использования знаний по химии в прикладной плоскости — использование раствора
Другой пример использования знаний по химии в прикладной плоскости — использование раствора

Соляная кислота
Однако этот подход рекомендуется только в том случае, если проблема не может быть решена безопасными методами. Главное в этом случае — соблюдение безопасности: работа в перчатках, маске и респираторе. Открытия последнего времени принесли человеку много сложных соединений, использующихся для уборки помещений, однако приготовить в домашних условиях эффективное средство тоже возможно.
Соляная кислота
Слайд 5Химия в кулинарии
Какие блюда можно приготовить, имея знания по практической химии? Наиболее
Химия в кулинарии
Какие блюда можно приготовить, имея знания по практической химии? Наиболее

Ацетат натрия
Это соединение является побочным продуктом реакции и по причине его появления становятся видны пузырьки, также можно услышать характерное шипение. Посмотреть, в какие еще химические реакции вступают вещества, которые мы используем в быту
Слайд 6Обеззараживание ядовитых соединений
Мало кто знает, что самый надежный способ борьбы с последствиями
Обеззараживание ядовитых соединений
Мало кто знает, что самый надежный способ борьбы с последствиями

Сульфид ртути (II)
Слайд 7Образование накипи в чайнике
В бытовых условиях нет химически чистой воды, в ней
Образование накипи в чайнике
В бытовых условиях нет химически чистой воды, в ней

Когда такая вода нагревается, эти соли подвергаются разложению на углекислый газ и нерастворимый осадок (СаСО3 и MgСО3). Эти твердые отложения вы и можете наблюдать, заглянув в чайник (а также взглянув на нагревательные элементы стиральных и посудомоечных машинок, утюгов).
Кроме кальция и магния (из которых получается карбонатная накипь), в воде также часто присутствует железо. В ходе химических реакций гидролиза и окисления из него образуются гидроксиды.
Кстати, собравшись избавиться от накипи в чайнике, вы можете наблюдать еще один пример занимательной химии в быту: с отложениями хорошо справляются обычный столовый уксус и лимонная кислота. Чайник с раствором уксуса/лимонной кислоты и воды кипятят, после чего накипь исчезает.
 Электролиз. Применение электролиза
Электролиз. Применение электролиза Химическая связь в комплексных соединениях
Химическая связь в комплексных соединениях Карбоновые кислоты
Карбоновые кислоты Углеводороды. Изомеры и гомологи
Углеводороды. Изомеры и гомологи Периодическая система Д.И.Менделеева
Периодическая система Д.И.Менделеева Алкины
Алкины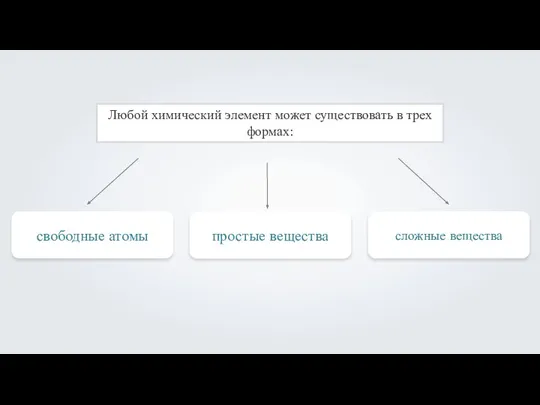 Строение атома
Строение атома f8ea0c69dfd043588bd2a8735e944773
f8ea0c69dfd043588bd2a8735e944773 Классификация неорганических веществ
Классификация неорганических веществ Алканы – строение, химические свойства
Алканы – строение, химические свойства Плотность вещества
Плотность вещества Свойства кальция и магния. Жёсткость воды. Лекция №7
Свойства кальция и магния. Жёсткость воды. Лекция №7 Щелочные металлы
Щелочные металлы Сравнительный анализ Фармакопейных статей для субстанций, представленных в мировых Фармакопеях
Сравнительный анализ Фармакопейных статей для субстанций, представленных в мировых Фармакопеях Постулаты Онзагера
Постулаты Онзагера Химические свойства алканов
Химические свойства алканов Коллоидно-химическая теория схватывания и твердения вяжущих веществ
Коллоидно-химическая теория схватывания и твердения вяжущих веществ Соли. Классификация солей
Соли. Классификация солей Красители vs пигменты
Красители vs пигменты Лекции_ ОБМЕН ЛИПИДОВ
Лекции_ ОБМЕН ЛИПИДОВ Углеводы
Углеводы Альдегиды
Альдегиды Спирты. Классификация
Спирты. Классификация Пероксид водорода
Пероксид водорода Химическое равновесие в гомогенных системах
Химическое равновесие в гомогенных системах Оптические свойства ювелирных камней. Цвет плеохроизм. Часть 1
Оптические свойства ювелирных камней. Цвет плеохроизм. Часть 1 Основы химической термодинамики
Основы химической термодинамики Важнейшие классы неорганических соединений
Важнейшие классы неорганических соединений