Слайд 2Константа диссоциации уксусной кислоты CH3COOH равна 1,72·10-5. Каков рН 0,085М раствора? Какова

степень диссоциации кислоты?
Слайд 3Константа диссоциации уксусной кислоты CH3COOH равна 1,72·10-5. Каков рН 0,085М раствора? Какова

степень диссоциации кислоты?
Ka = [CH3COO-][H+] / [CH3COOH] = 1,72·10-5
C0 = [CH3COO-] + [CH3COOH] = 0,085
[H+] = [CH3COO-]
x = [H+] = [CH3COO-]
[CH3COOH] = C0 - [CH3COO-]
Ka = x2/(C0 – x)
x2 + Kax - KaC0 = 0
x = (-Ka + √D)/2 ≈ √(KaC0)= 1,2·10-3
pH = -log[H+] = 2,92
Слайд 4Степень диссоциации некоторого раствора муравьиной кислоты составляет 4,2%. Как изменится электропроводность раствора

при нейтрализации кислоты концентрированным раствором KOH?
Значения λ∞ для ионов:
H+ 315; K+ 65
HCOO- 47; OH- 174
Слайд 5Степень диссоциации некоторого раствора муравьиной кислоты составляет 4,2%. Как изменится электропроводность раствора

при нейтрализации кислоты концентрированным раствором KOH?
Значения λ∞ для ионов:
H+ 315; K+ 65
HCOO- 47; OH- 174
HCOOH + KOH = HCOOK + H2O
Т.к. р-р КОН концентрированный, то С(HCOOH)≈ С(HCOOK)
λ∞(HCOOH) = λ∞(H+) + λ∞(HCOO-) = 362
λ (HCOOH) = λ∞(HCOOH)· α = 362·0,042=15,2
λ∞(HCOOK) = λ∞(K+) + λ∞(HCOO-) = 112 = λ (HCOOK)
λ (HCOOK) / λ (HCOOH) = 112/15,2 = 7,4
Слайд 6Найти ЭДС гальванического элемента, состоящего из цинкового (0,085М) и серебряного (0,11М) электродов.
E0(Ag+/Ag)

= +0,800 В E0(Zn2+/Zn) = -0,763 В
Слайд 7Найти ЭДС гальванического элемента, состоящего из цинкового (0,085М) и серебряного (0,11М) электродов.
E0(Ag+/Ag)

= +0,800 В
E0(Zn2+/Zn) = -0,763 В
U = Ek – Ea
Уравнение Нернста:
E = E0 + (0.059/n)∙log([ox]/[red])
Ek = 0,800 + (0,059/1)∙log(0,11/1) = 0,743
Ea = -0,763 + (0,059/2)∙log(0,085/1) = -0,795
U = 1,538 (В)
Слайд 8ЭДС гальванического элемента, состоящего из хлорсеребряного и хингидронного электродов, равна 0,21 В.

Найти рН хингидронного электрода.
EХГ,0 = 0,69 В
EХC = 0,222 В







 Углеводы
Углеводы Термодинамика
Термодинамика Практические задания по химии
Практические задания по химии Катализаторы и катализ
Катализаторы и катализ Кислород. 8 класс
Кислород. 8 класс Полиамиды (ПА)
Полиамиды (ПА) бирюза
бирюза Эффект растворителя при определении пространственной структуры сложных гетероциклических соединений
Эффект растворителя при определении пространственной структуры сложных гетероциклических соединений Углерод. Положение в ПС и особенности строения атома
Углерод. Положение в ПС и особенности строения атома Полімери. Пінополістирол
Полімери. Пінополістирол Белки́ (протеины, полипепти́ды)
Белки́ (протеины, полипепти́ды) ліпіди
ліпіди Понятие о химической реакции. Реакции, идущие без изменения состава веществ. 11 класс
Понятие о химической реакции. Реакции, идущие без изменения состава веществ. 11 класс каталитический крекинг
каталитический крекинг Презентация на тему Химия в криминалистике
Презентация на тему Химия в криминалистике  Химия һәм сәламәт яшәү рәвеше
Химия һәм сәламәт яшәү рәвеше Презентация на тему Характеристика элементов VII группы главной подгруппы. Хлор
Презентация на тему Характеристика элементов VII группы главной подгруппы. Хлор  kristallichekaya_reshenka_vidy
kristallichekaya_reshenka_vidy Неорганические вещества в быту
Неорганические вещества в быту Общая характеристика элементов группы, главной подгруппы
Общая характеристика элементов группы, главной подгруппы Сущность химических реакций и признаки их протекания
Сущность химических реакций и признаки их протекания Подготовка учащихся к государственной (итоговой) аттестации по химии
Подготовка учащихся к государственной (итоговой) аттестации по химии Основой для расчета реакторов с учетом теплового режима служит уравнение теплового баланса
Основой для расчета реакторов с учетом теплового режима служит уравнение теплового баланса Презентация на тему Великие ученые-химики
Презентация на тему Великие ученые-химики  Кислоты
Кислоты Презентация по Химии "Токсическое действие неорганических веществ"
Презентация по Химии "Токсическое действие неорганических веществ" 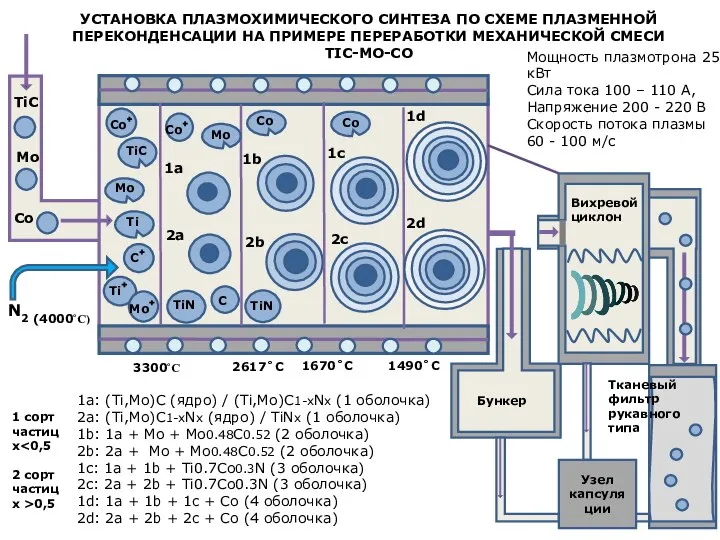 Установка плазмохимического синтеза по схеме плазменной переконденсации на примере переработки механической смеси tic-mo-co
Установка плазмохимического синтеза по схеме плазменной переконденсации на примере переработки механической смеси tic-mo-co Ароматические углеводороды
Ароматические углеводороды