Содержание
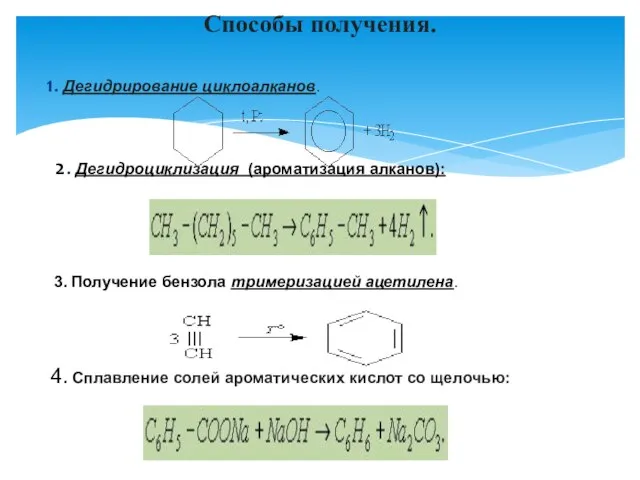
- 2. 1. Дегидрирование циклоалканов. 2. Дегидроциклизация (ароматизация алканов): 3. Получение бензола тримеризацией ацетилена. 4. Сплавление солей ароматических
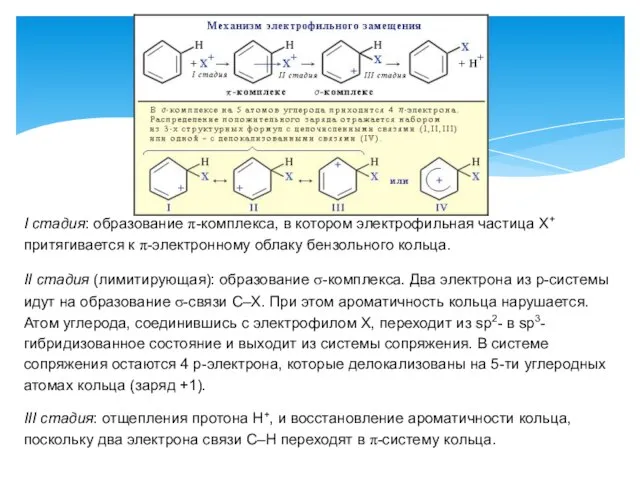
- 3. Обладая подвижной шестеркой p -электронов, ароматическое ядро является удобным объектом для атаки электрофильными реагентами. Этому способствует
- 4. I стадия: образование π-комплекса, в котором электрофильная частица Х+ притягивается к π-электронному облаку бензольного кольца. II
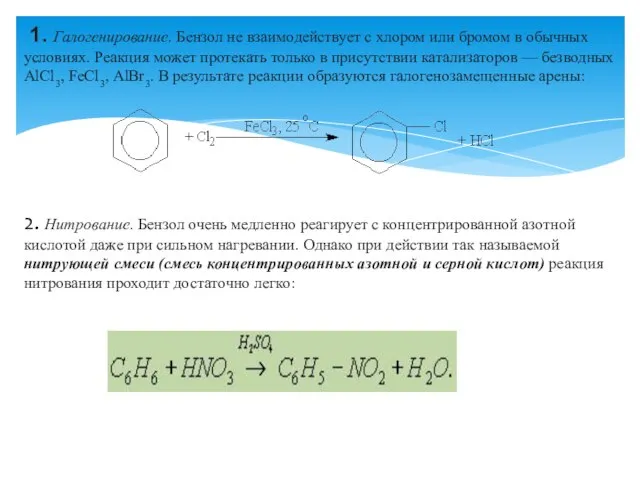
- 5. 1. Галогенирование. Бензол не взаимодействует с хлором или бромом в обычных условиях. Реакция может протекать только
- 6. 3. Алкилирование по Фриделю—Крафтсу. В результате реакции происходит введение в бензольное ядро алкильной группы с получением
- 7. 4.Алкилирование алкенами. Эти реакции широко используются в промышленности для получения этилбензола и изопропилбензола (кумола). Алкилирование проводят
- 8. Важнейшим фактором, определяющим химические свойства молекулы, является распределение в ней электронной плотности. Характер распределения зависит от
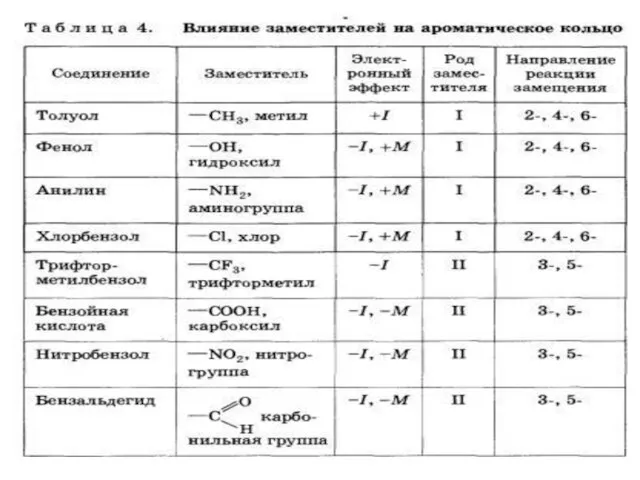
- 9. Заместители подразделяют на две группы в зависимости от проявляемого ими эффекта (мезомерного или индуктивного): 1.электронодонорные 2.электроноакцепторные.
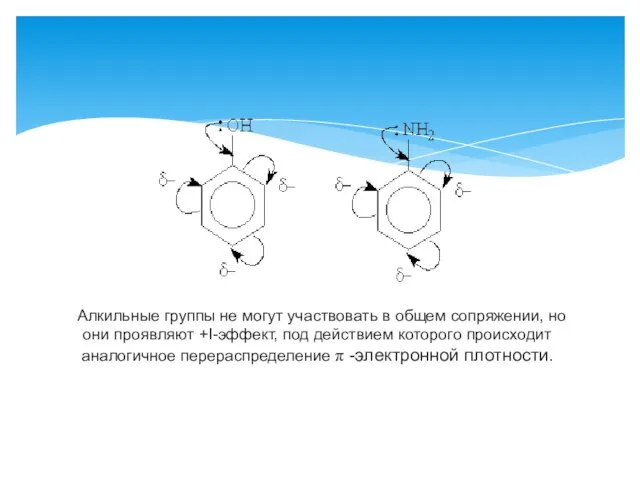
- 10. Алкильные группы не могут участвовать в общем сопряжении, но они проявляют +I-эффект, под действием которого происходит
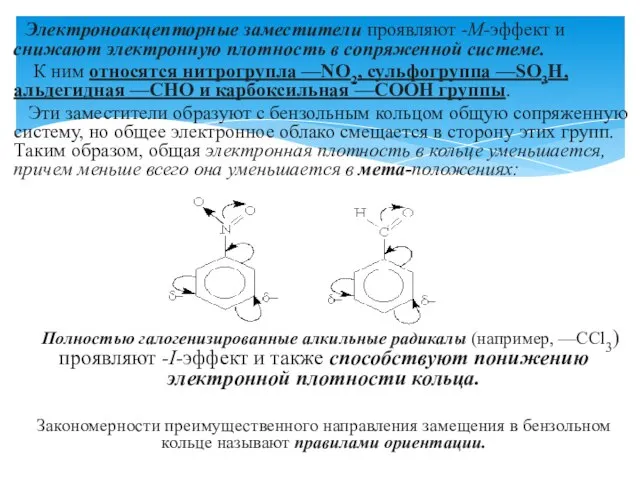
- 11. Электроноакцепторные заместители проявляют -М-эффект и снижают электронную плотность в сопряженной системе. К ним относятся нитрогрупла —NO2,
- 12. Заместители, обладающие +I-эффектом или +М-эффектом, способствуют электрофильному замещению в орто- и пара-положениях бензольного кольца и называются
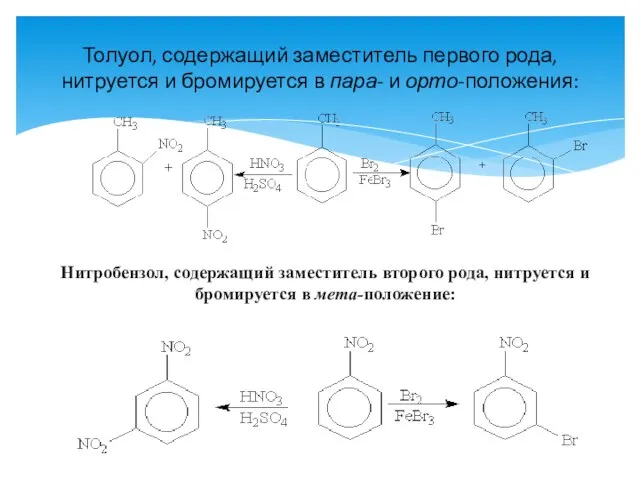
- 13. Толуол, содержащий заместитель первого рода, нитруется и бромируется в пара- и орто-положения: Нитробензол, содержащий заместитель второго
- 15. 1. Гидрирование. Реакция присоединения водорода к аренам идет при нагревании и высоком давлении в присутствии металлических
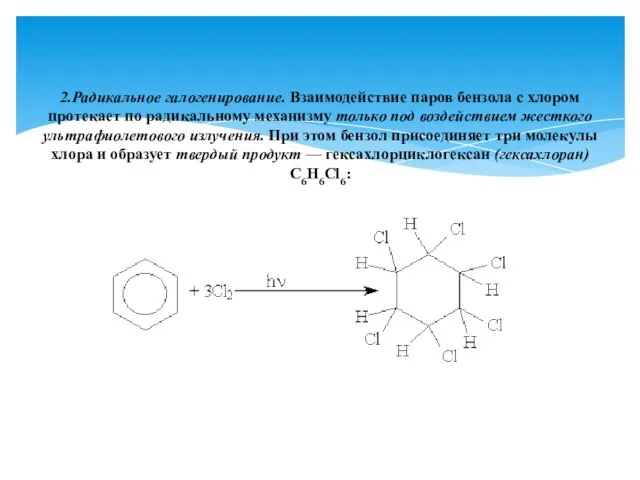
- 16. 2.Радикальное галогенирование. Взаимодействие паров бензола с хлором протекает по радикальному механизму только под воздействием жесткого ультрафиолетового
- 17. Метильная группа проявляет положительный индуктивный эффект по отношению к бензольному кольцу. Соответственно бензольное кольцо обладает отрицательным
- 19. Скачать презентацию








 Химический калейдоскоп
Химический калейдоскоп Строение комплексных соединений. Лекция 4
Строение комплексных соединений. Лекция 4 ОСОБЕННОСТИ СТРОЕНИЯ, РЕАКЦИОННОЙ СПОСОБНОСТИ И МЕТОДЫ СИНТЕЗА АЛКИНОВ
ОСОБЕННОСТИ СТРОЕНИЯ, РЕАКЦИОННОЙ СПОСОБНОСТИ И МЕТОДЫ СИНТЕЗА АЛКИНОВ Чугуны
Чугуны Понятие о химической реакции. Реакции, идущие без изменения состава веществ
Понятие о химической реакции. Реакции, идущие без изменения состава веществ Toshkent davlat texnika instituti
Toshkent davlat texnika instituti Сода. Что я знаю о ней!?
Сода. Что я знаю о ней!? Висмут Bi
Висмут Bi Строение атома
Строение атома Составление химических уравнений
Составление химических уравнений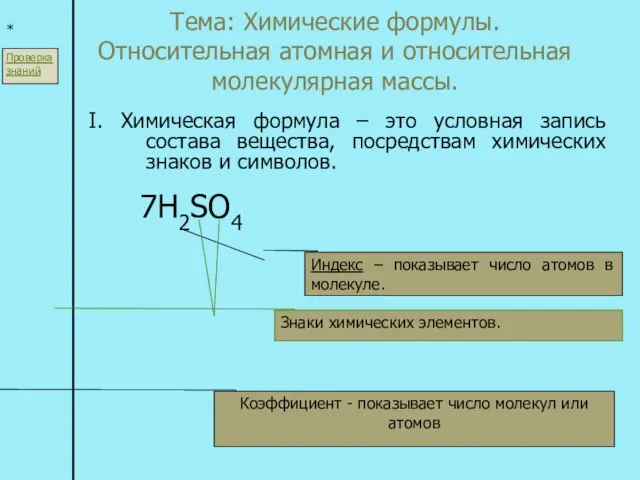 Тема: Химические формулы. Относительная атомная и относительная молекулярная массы. I. Химическая формула – это условная запись с
Тема: Химические формулы. Относительная атомная и относительная молекулярная массы. I. Химическая формула – это условная запись с Важнейшие соединения хлора
Важнейшие соединения хлора Melatonin. Краткий экскурс
Melatonin. Краткий экскурс АКТИВІЗАЦІЯ ТВОРЧОЇ ДІЯЛЬНОСТІ УЧНІВ У ПРОЦЕСІ СТВОРЕННЯ І ВИКОРИСТАННЯ ПРОЕКТІВ У POWER POINT НА УРОКАХ ХІМІЇ
АКТИВІЗАЦІЯ ТВОРЧОЇ ДІЯЛЬНОСТІ УЧНІВ У ПРОЦЕСІ СТВОРЕННЯ І ВИКОРИСТАННЯ ПРОЕКТІВ У POWER POINT НА УРОКАХ ХІМІЇ Предмет химии. Вещества и их свойства
Предмет химии. Вещества и их свойства Классификация органических веществ
Классификация органических веществ Алканы
Алканы 8-12 химические реакции
8-12 химические реакции Химические реакции
Химические реакции Арены. Бензол
Арены. Бензол Строение бензола
Строение бензола Ацетиленовые углеводороды (алкины). Лекция №7
Ацетиленовые углеводороды (алкины). Лекция №7 Подготовка к ЕГЭ
Подготовка к ЕГЭ Предмет органической химии
Предмет органической химии Туф вулканический
Туф вулканический Бутилацетат. Химическая формула бутилацетата
Бутилацетат. Химическая формула бутилацетата Химическая идентификация основных классов биомолекул
Химическая идентификация основных классов биомолекул Тест по теме: Алкины
Тест по теме: Алкины