Содержание
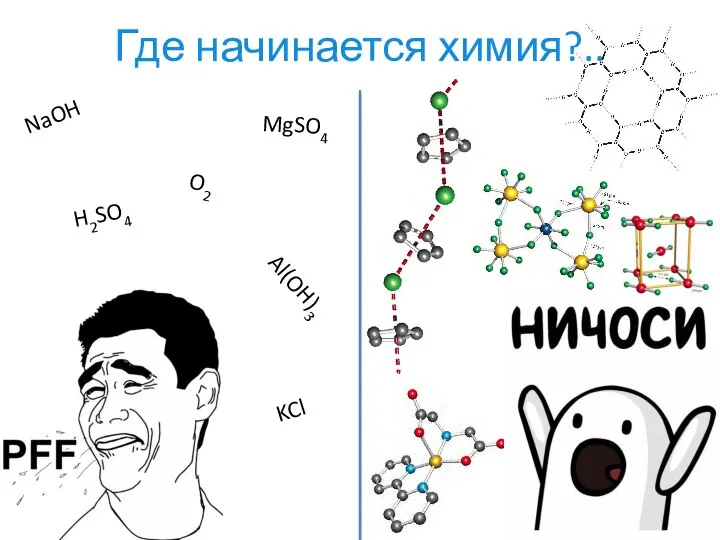
- 2. Где начинается химия?.. NaOH MgSO4 Al(OH)3 O2 H2SO4 KCl
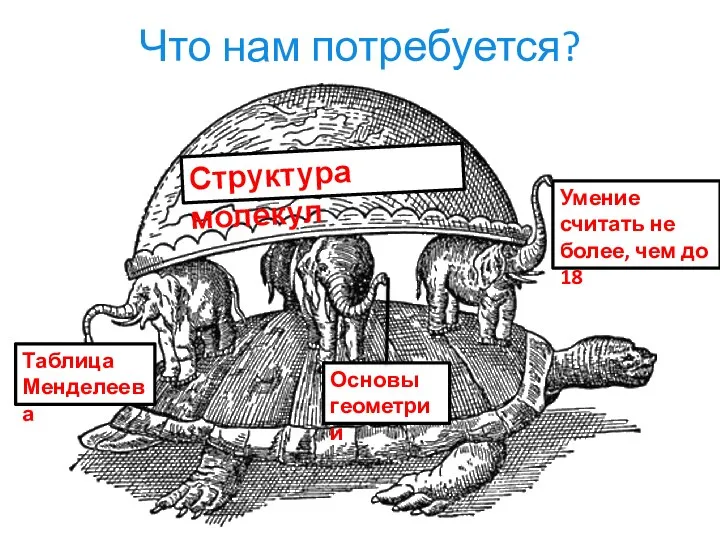
- 3. Что нам потребуется? Структура молекул Таблица Менделеева Основы геометрии Умение считать не более, чем до 18
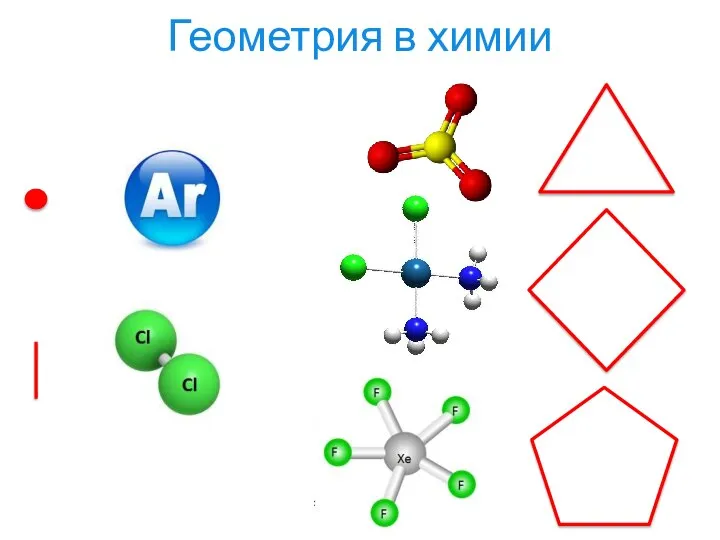
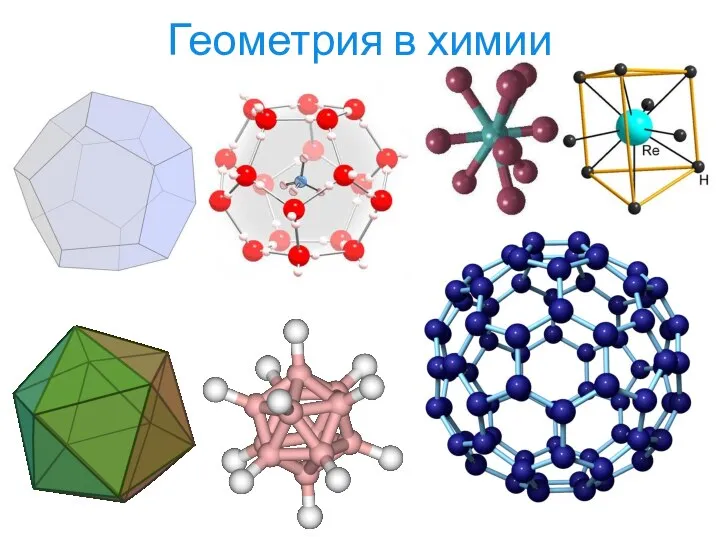
- 4. Геометрия в химии
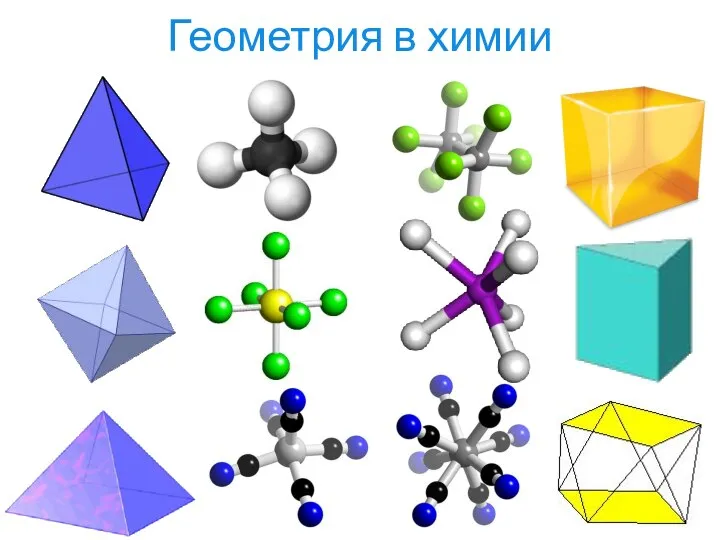
- 5. Геометрия в химии
- 6. Геометрия в химии
- 7. Метод валентных связей 1e 2e 3e 4e 5e 6e 7e 8e
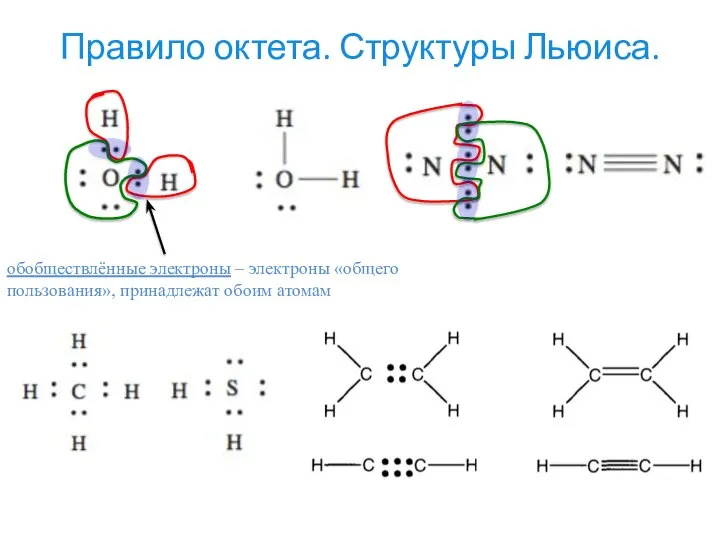
- 8. Правило октета. Структуры Льюиса. обобществлённые электроны – электроны «общего пользования», принадлежат обоим атомам
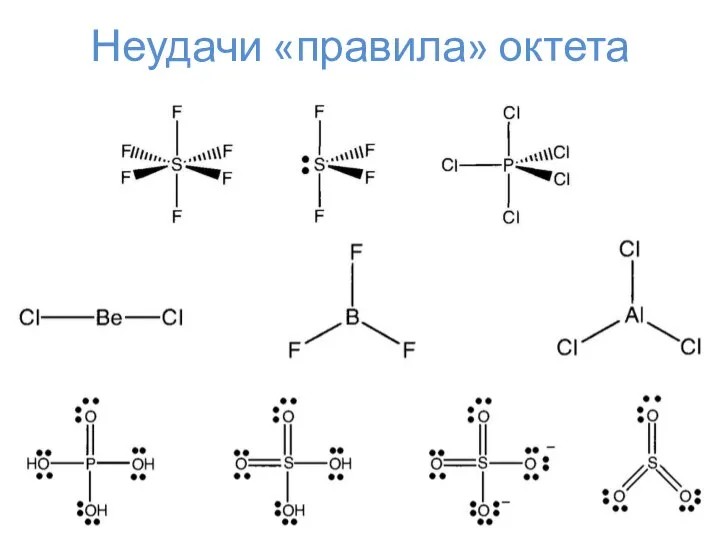
- 9. Неудачи «правила» октета
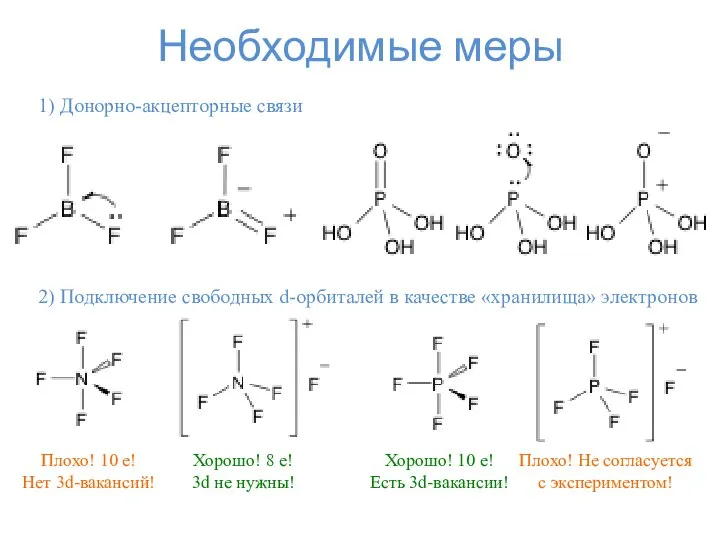
- 10. Необходимые меры 1) Донорно-акцепторные связи 2) Подключение свободных d-орбиталей в качестве «хранилища» электронов Плохо! 10 e!
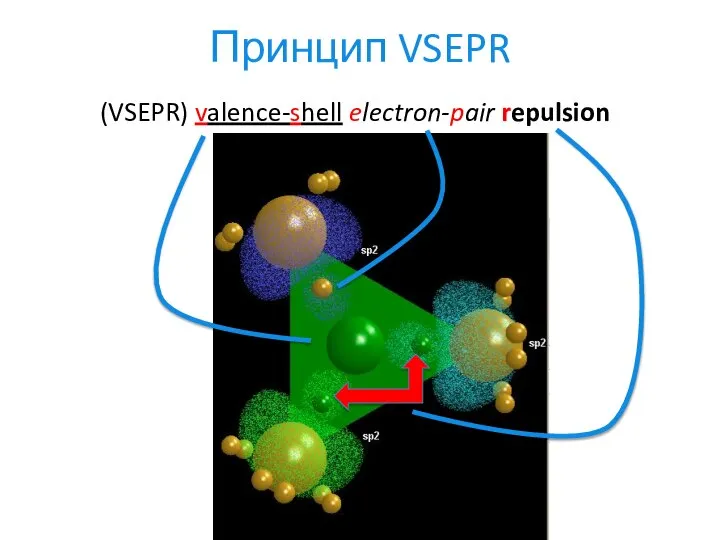
- 11. Принцип VSEPR (VSEPR) valence-shell electron-pair repulsion
- 12. Принцип VSEPR
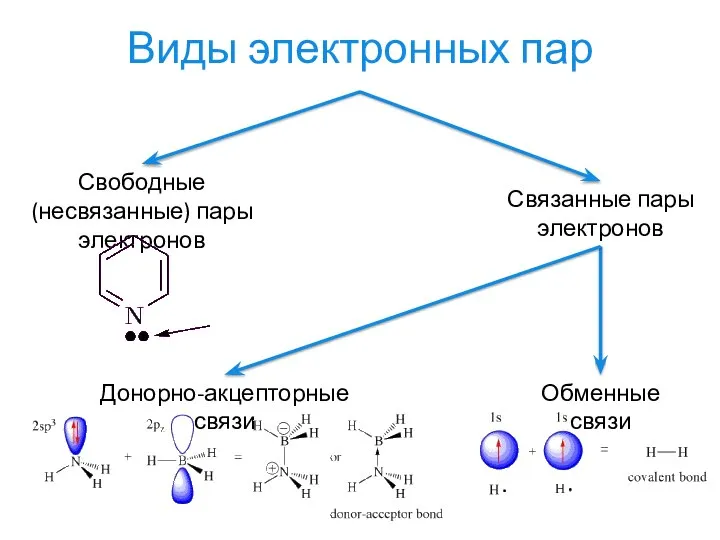
- 13. Виды электронных пар Свободные (несвязанные) пары электронов Связанные пары электронов Обменные связи Донорно-акцепторные связи
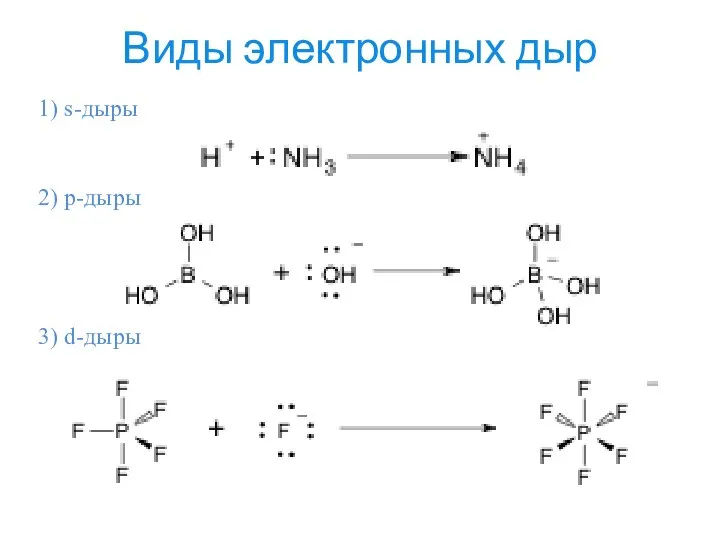
- 14. Виды электронных дыр 1) s-дыры 2) p-дыры 3) d-дыры
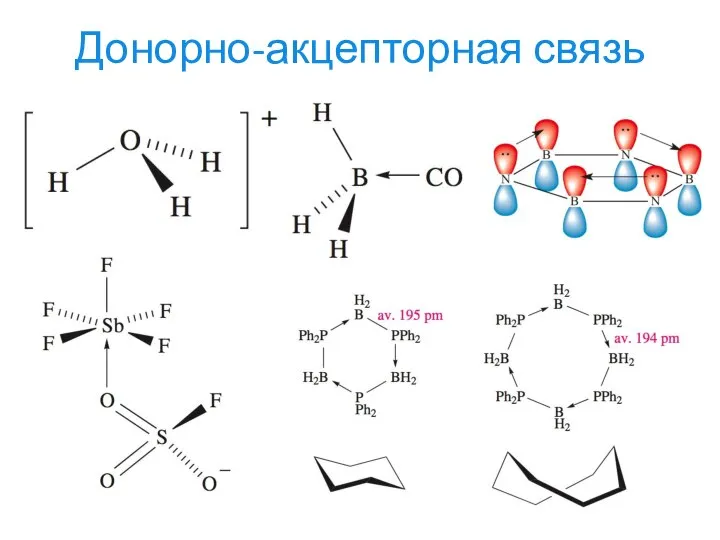
- 15. Донорно-акцепторная связь
- 16. Принцип VSEPR (правила Гиллеспи) Пары электронов внешней оболочки центрального атома испытывают взаимное отталкивание; Электронное отталкивание между
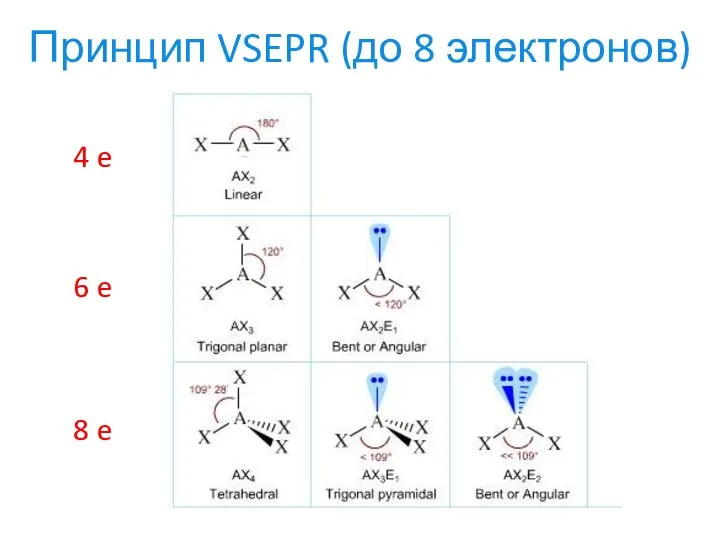
- 17. Принцип VSEPR (до 8 электронов) 4 e 6 e 8 e
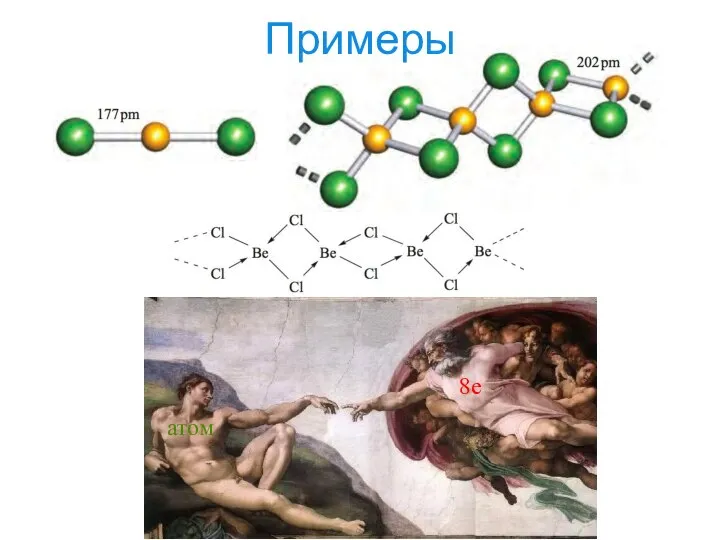
- 18. Примеры 8e атом
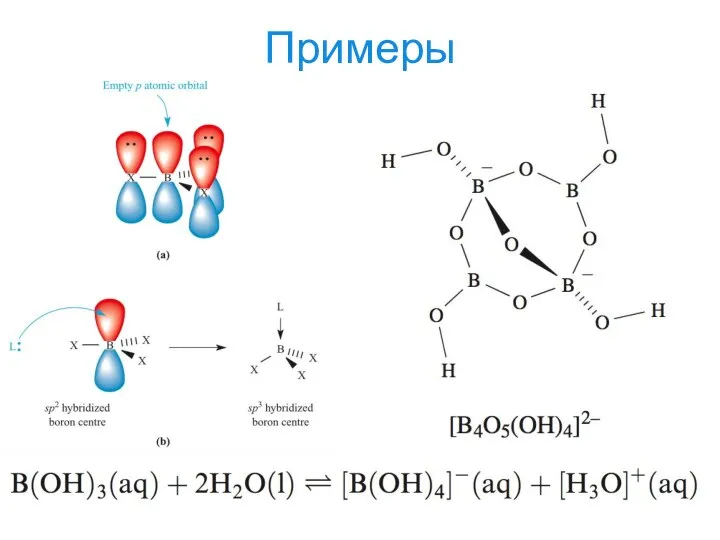
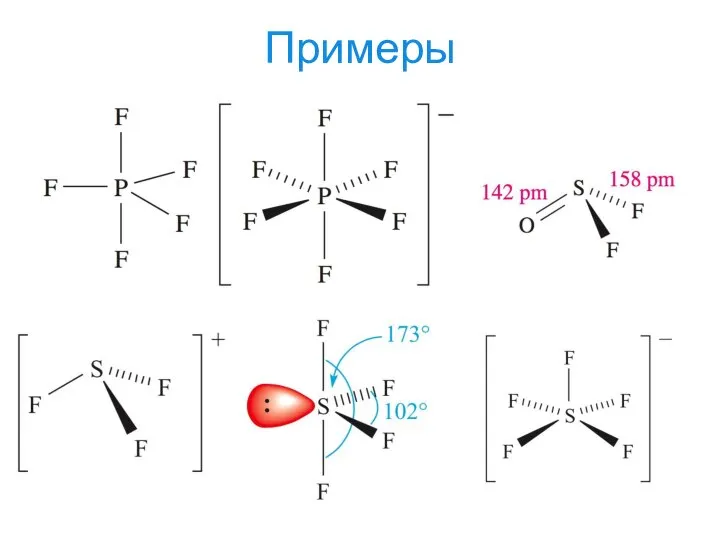
- 19. Примеры
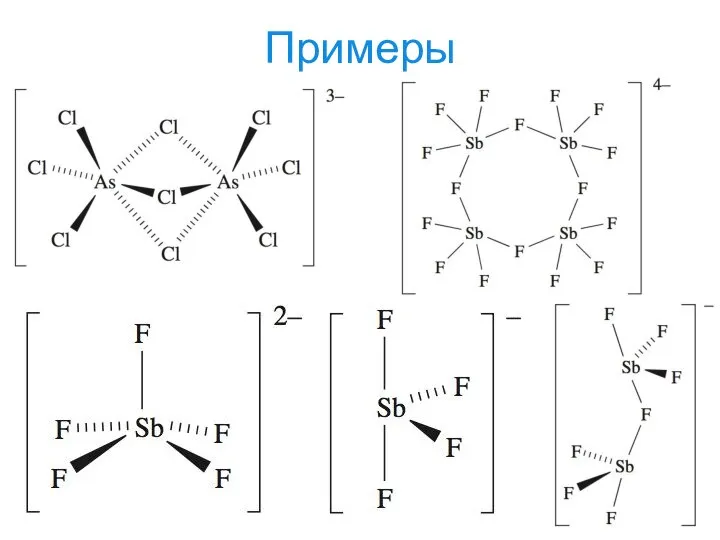
- 20. Примеры [Be4(μ4-O)(μ-O2CMe)6]
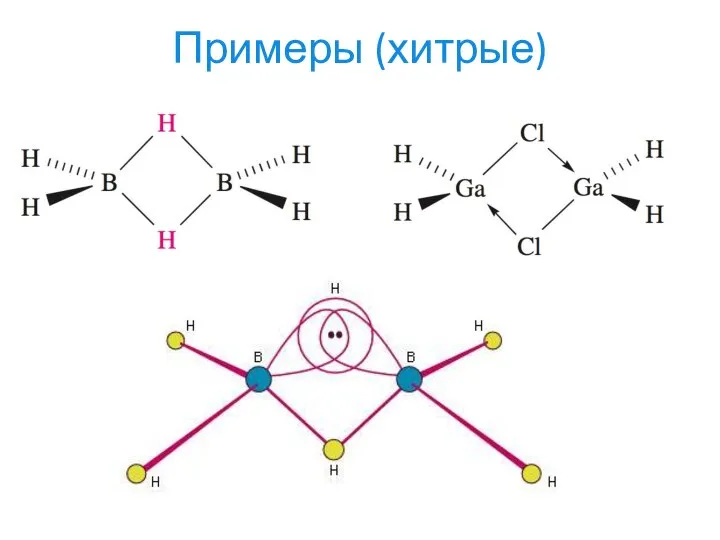
- 21. Примеры (хитрые)
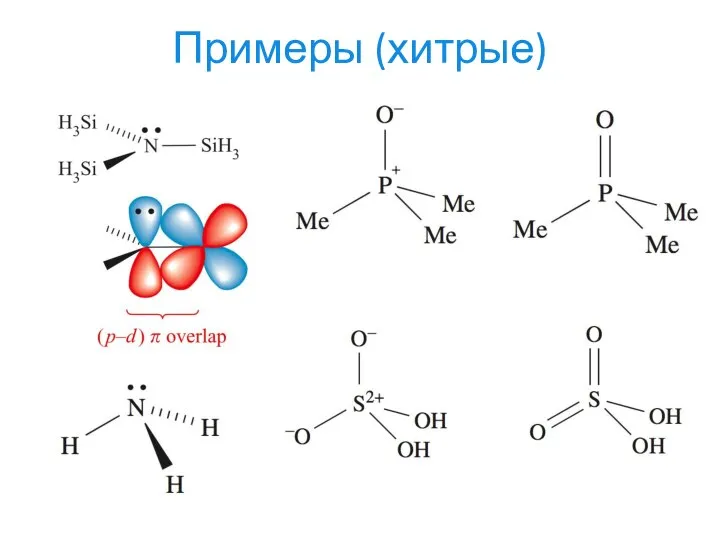
- 22. Примеры (хитрые)
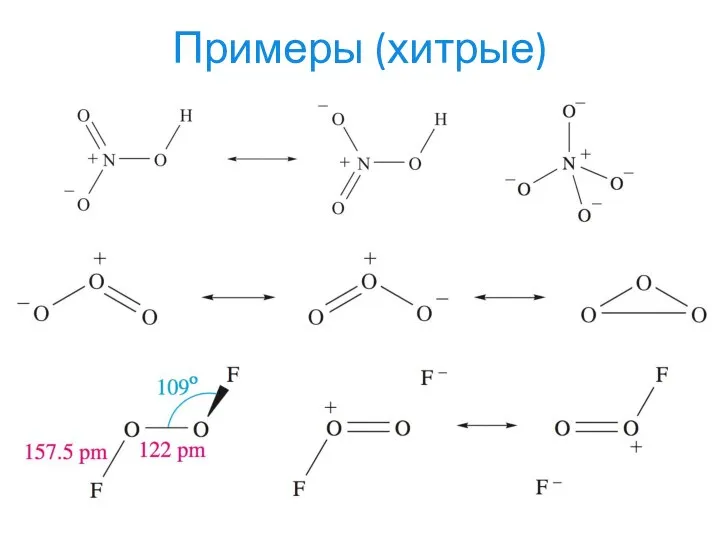
- 23. Примеры (хитрые)
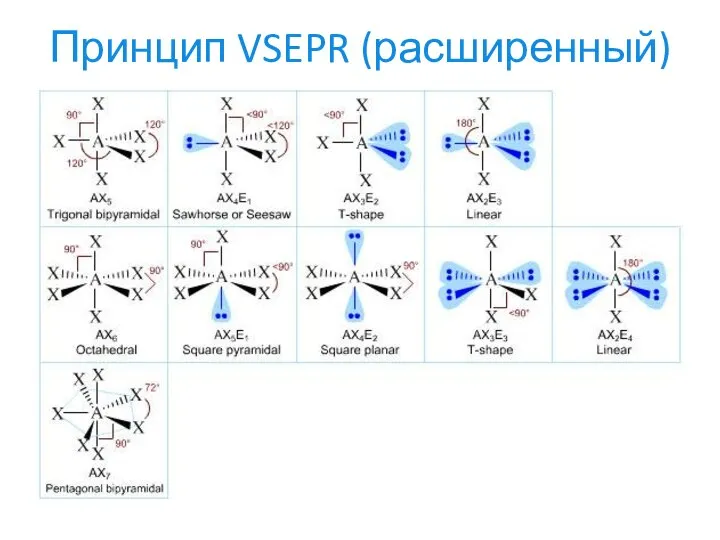
- 24. Принцип VSEPR (расширенный)
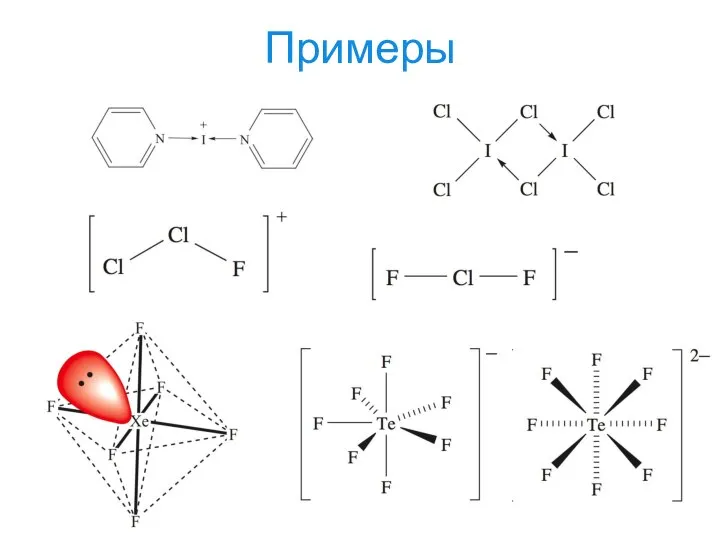
- 25. Примеры
- 26. Примеры
- 27. Примеры
- 28. Применим только для предсказания строения p-элементов Наблюдаются отклонения от правила из-за наличия стереохимически инертной s-пары у
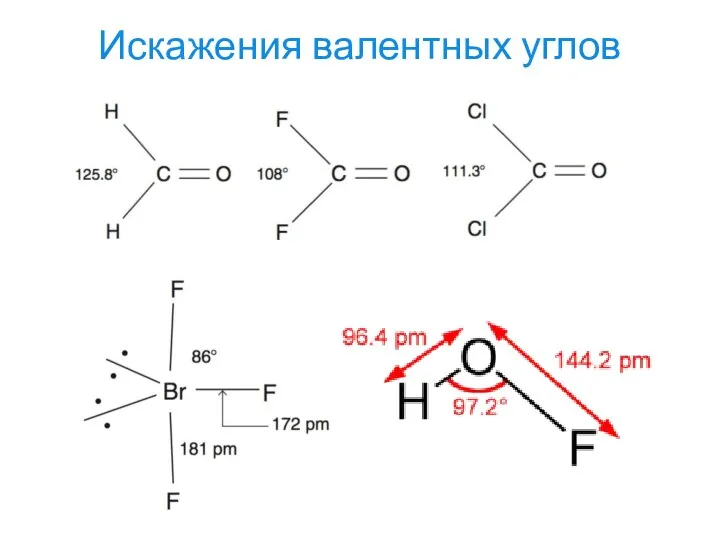
- 29. Искажения валентных углов
- 31. Скачать презентацию


![Примеры [Be4(μ4-O)(μ-O2CMe)6]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/940787/slide-19.jpg)

 Металлы. Своя игра
Металлы. Своя игра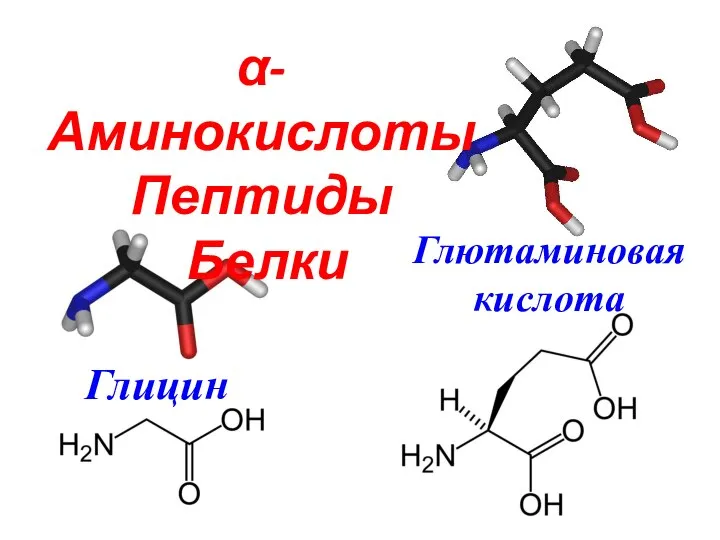 α-Аминокислоты
α-Аминокислоты Ионные уравнения реакций
Ионные уравнения реакций Жиры. Сложные эфиры
Жиры. Сложные эфиры Заполни электронные уровни элементов
Заполни электронные уровни элементов Презентация на тему Расчеты по химическим уравнениям
Презентация на тему Расчеты по химическим уравнениям  Презентация по Химии "Строении атомов. Химическая связь"
Презентация по Химии "Строении атомов. Химическая связь"  8-11 2 валентность
8-11 2 валентность Кислоты и соли
Кислоты и соли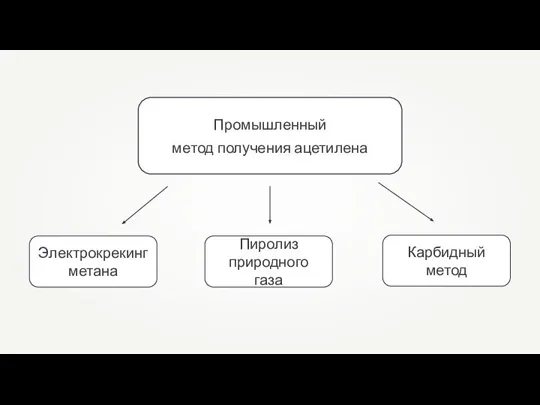 Промышленный метод получения ацетилена
Промышленный метод получения ацетилена Презентация по химии на тему _Закон постоянства со
Презентация по химии на тему _Закон постоянства со Кипение. Испарение
Кипение. Испарение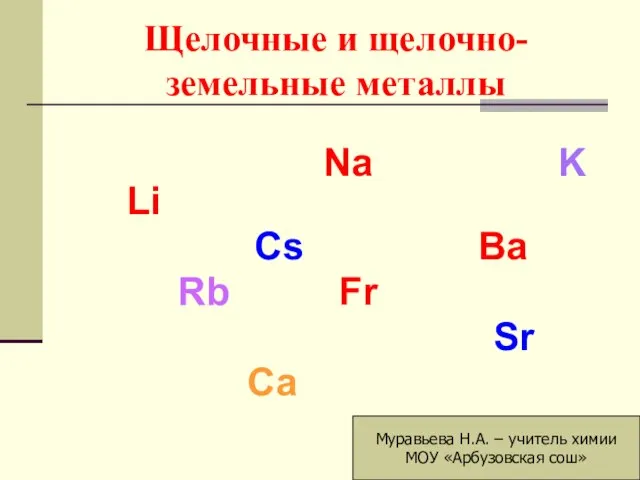 Презентация на тему Щелочные и щелочноземельные металлы
Презентация на тему Щелочные и щелочноземельные металлы  Ковалентная неполярная связь
Ковалентная неполярная связь Презентация на тему Железо и его соединения
Презентация на тему Железо и его соединения  Круговорот серы в природе
Круговорот серы в природе Подготовка к ГИА по химии
Подготовка к ГИА по химии Карбонаты. Лекция 12
Карбонаты. Лекция 12 Углерод. Положение в ПС и особенности строения атома
Углерод. Положение в ПС и особенности строения атома Строение и химический состав костей, рост костей
Строение и химический состав костей, рост костей Характеристика элемента по его положению в периодической системе
Характеристика элемента по его положению в периодической системе Основания: определение, классификация, химические свойства
Основания: определение, классификация, химические свойства Кислоты, их классификация и свойства
Кислоты, их классификация и свойства Презентация на тему Металлы и неметаллы
Презентация на тему Металлы и неметаллы  Лекарственные средства – производные пиримидина
Лекарственные средства – производные пиримидина карбоновые кислоты
карбоновые кислоты Металлы и неметаллы. Ознакомление с общими физическими свойствами металлов и неметаллов
Металлы и неметаллы. Ознакомление с общими физическими свойствами металлов и неметаллов Адсорбция. Механизмы адсорбции. Термодинамика адсорбции. Лекция 5
Адсорбция. Механизмы адсорбции. Термодинамика адсорбции. Лекция 5