Содержание
- 2. Vodík Výskyt - ve vesmíru (nejrozšířenější prvek) - na Zemi vázán v hydrosféře - v lidském
- 3. Fyzikální vlastnosti - bezbarvý plyn - bez chuti a zápachu - nejlehčí plyn jsou známy 3
- 4. Chemické vlastnosti - tvořen dvouatomovými molekulami - molekula není příliš reaktivní - ve vodě je jen
- 5. Příprava a výroba Příprava (v laboratoři) elektrolýza vody v roztoku jsou přítomny ionty H a OH
- 6. reakce kovů I.A a II.A s vodou Navrhněte, jak dokážete vznikající NaOH reakce méně ušlechtilých kovů
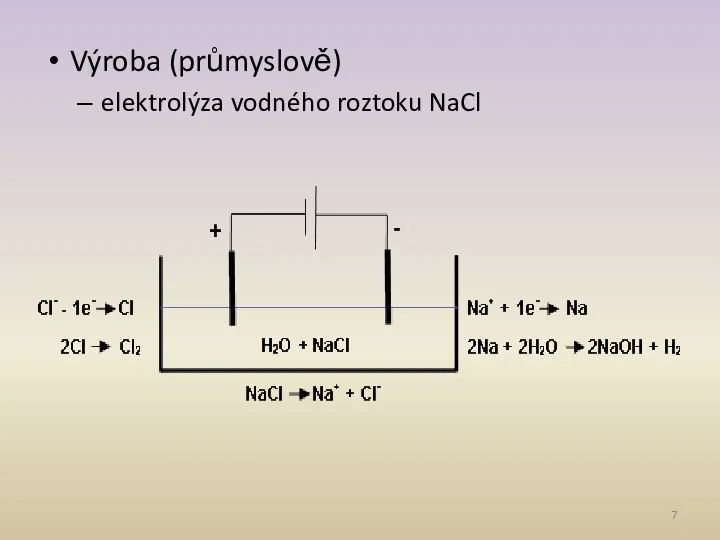
- 7. Výroba (průmyslově) elektrolýza vodného roztoku NaCl
- 8. termické štěpení metanu reakce vodní páry s rozžhaveným koksem
- 9. Použití vodíku je významným redukčním činidlem výroba amoniaku - NH3 v organických syntézách (př. ztužování tuků)
- 10. Sloučeniny vodíku Hydridy - binární sloučeniny vodíku s jinými prvky iontové hydridy - oxidační číslo vodíku
- 11. b) Kovalentní hydridy - oxidační číslo vodíku = s nekovy a polokovy názvy tvořeny jedním slovem
- 12. c) Kovové (intersticiální) hydridy - atomy vodíku se vmezeří do kovové mřížky přechodných kovů. Jejich složení
- 14. Скачать презентацию










 Изучение геохимических свойств редкоземельных элементов
Изучение геохимических свойств редкоземельных элементов Подгруппа алюминия
Подгруппа алюминия Природные источники углеводородов
Природные источники углеводородов Изомерия аминокислот
Изомерия аминокислот Алканы
Алканы Типы химических реакций
Типы химических реакций Кислородсодержащие органические вещества. Тест
Кислородсодержащие органические вещества. Тест Безопасная пластмасса
Безопасная пластмасса Аллотропия углерода
Аллотропия углерода Физико-химия полимеров
Физико-химия полимеров Практическая работа. Решение экспериментальных задач по неорганической химии с использованием виртуальной лаборатории
Практическая работа. Решение экспериментальных задач по неорганической химии с использованием виртуальной лаборатории Металлы и их соединения
Металлы и их соединения Магматические горные породы
Магматические горные породы Основания. Химические свойства.получение
Основания. Химические свойства.получение Белки. Химия
Белки. Химия Химическая мастерская
Химическая мастерская Презентация на тему Алкины
Презентация на тему Алкины  Химический футбол на тему: Химия вокруг нас
Химический футбол на тему: Химия вокруг нас Кислые горные породы
Кислые горные породы Каучук
Каучук Строение вещества
Строение вещества Химическая география чудес
Химическая география чудес Количество вещества. Моль
Количество вещества. Моль Чистые вещества и смеси. Использование химического анализа
Чистые вещества и смеси. Использование химического анализа Золь. Свойства золи
Золь. Свойства золи Фізика гірських порід і процесів. Хімічні зв'язки в мінералах. Іонний зв'язок
Фізика гірських порід і процесів. Хімічні зв'язки в мінералах. Іонний зв'язок 6. Характеристика элементов на основе положения в периодической системе
6. Характеристика элементов на основе положения в периодической системе Структура неорганических ионных соединений. Лекция 12
Структура неорганических ионных соединений. Лекция 12