Содержание
- 2. Цели урока: 1)Познакомить учащихся с понятием ионные уравнения и ионные реакции; 2)рассмотреть случаи, при которых реакции
- 3. Ионы Большинство химических реакций протекает в растворах. Растворы электролитов содержат ионы. Ионы – это положительно или
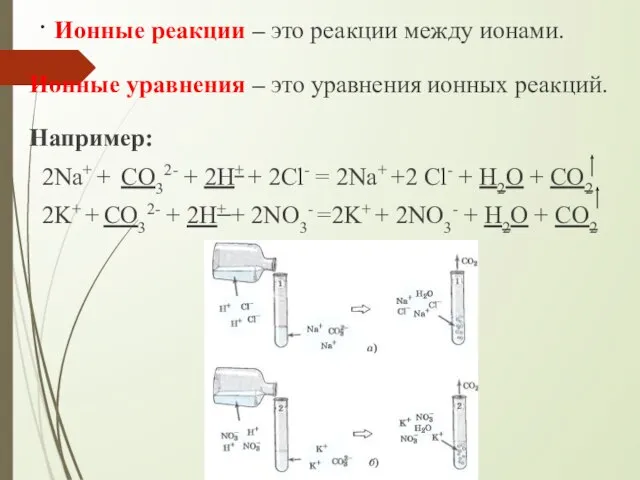
- 4. . Ионные реакции – это реакции между ионами. Ионные уравнения – это уравнения ионных реакций. Например:
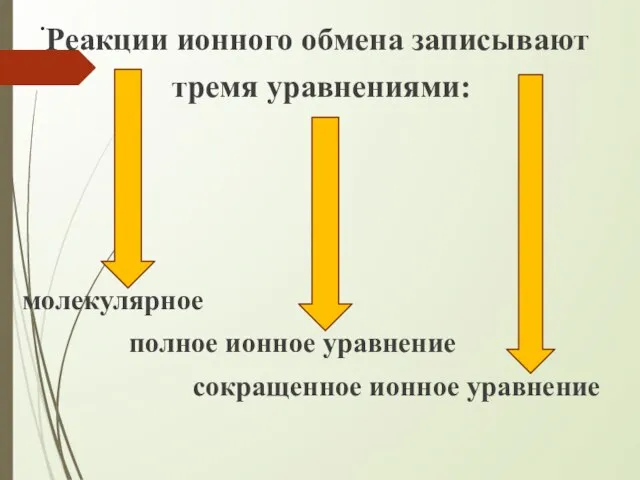
- 5. . Реакции ионного обмена записывают тремя уравнениями: молекулярное полное ионное уравнение сокращенное ионное уравнение
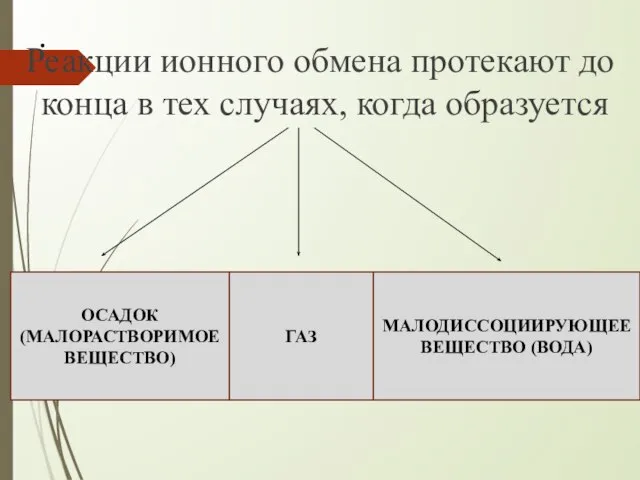
- 6. . Реакции ионного обмена протекают до конца в тех случаях, когда образуется ОСАДОК (МАЛОРАСТВОРИМОЕ ВЕЩЕСТВО) ГАЗ
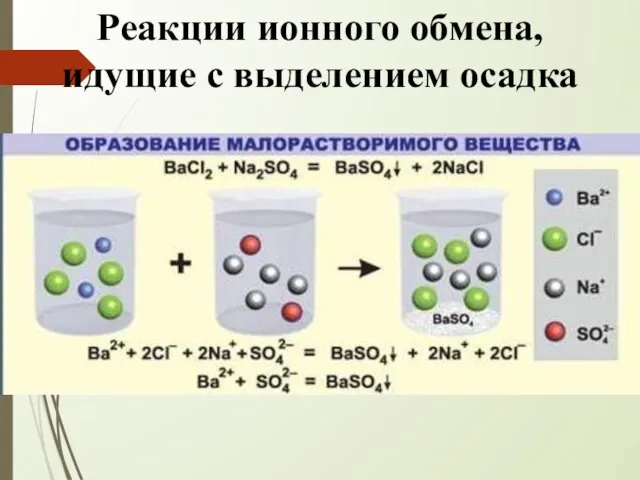
- 7. Реакции ионного обмена, идущие с выделением осадка
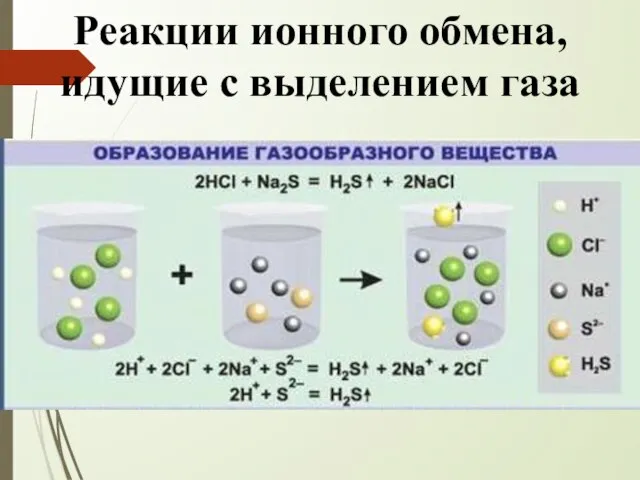
- 8. Реакции ионного обмена, идущие с выделением газа
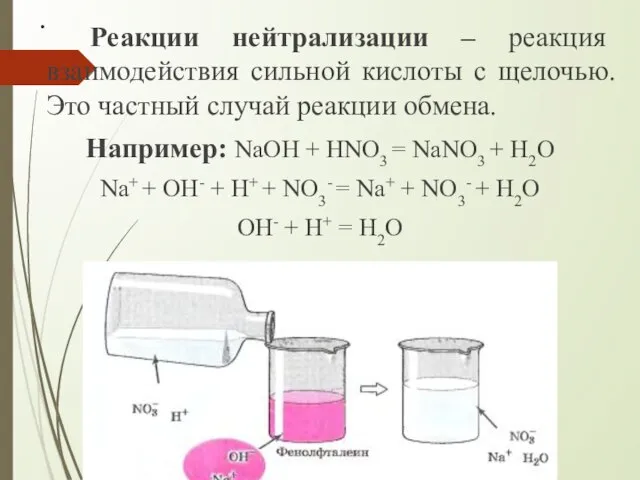
- 10. . Реакции нейтрализации – реакция взаимодействия сильной кислоты с щелочью. Это частный случай реакции обмена. Например:
- 11. Домашнее задание: § 38, упр. 1,2.
- 12. Решение ионных уравнений. 14.04.2021.
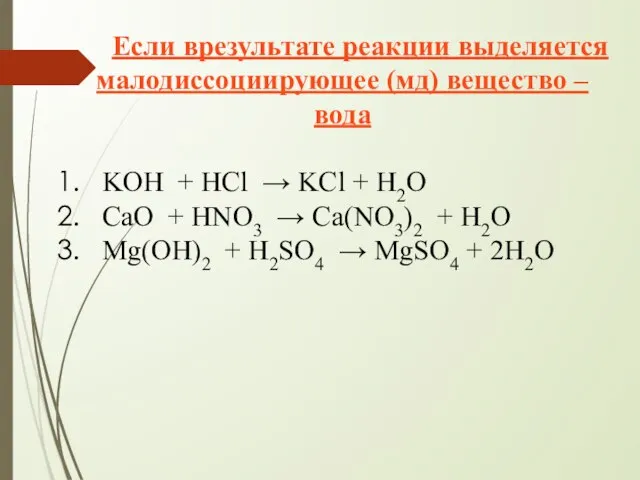
- 13. Если врезультате реакции выделяется малодиссоциирующее (мд) вещество – вода KOH + HCl → KCl + H2O
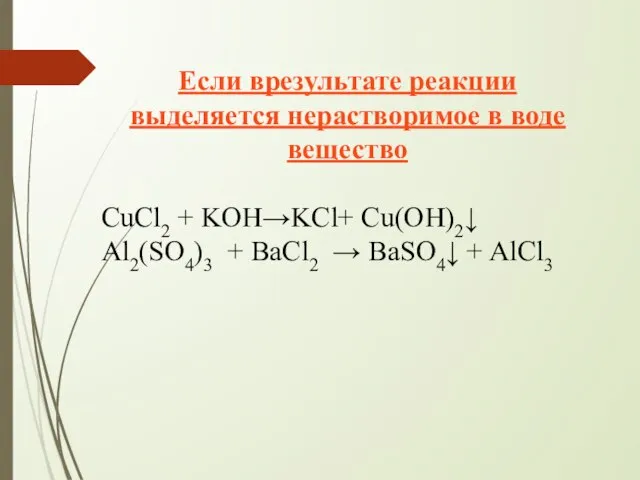
- 14. Если врезультате реакции выделяется нерастворимое в воде вещество CuCl2 + KOH→KCl+ Cu(OH)2↓ Al2(SO4)3 + BaCl2 →
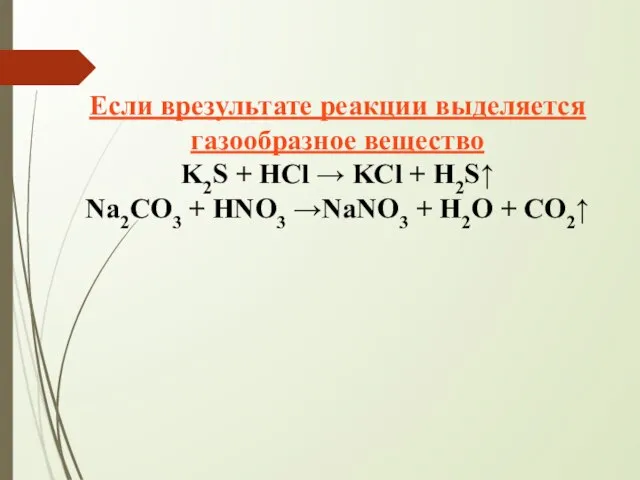
- 15. Если врезультате реакции выделяется газообразное вещество K2S + HCl → KCl + H2S↑ Na2CO3 + HNO3
- 16. Домашнее задание: §38, упр.3; подготовиться к проверочной работе
- 17. Обобщение темы Тест «Проверь себя»: 1) Ионные реакции – это реакции между: а) нейтральными атомами б)
- 18. . 4) Какое вещество надо добавить к соляной кислоте, чтобы в результате реакции выделился газ: а)
- 19. Ответы: 1. б 2. а 3. а 4. в 5. г
- 21. Скачать презентацию









 Получение и применение алкадиенов
Получение и применение алкадиенов Проект в сфере экологического волонтерства преподавателя химии первой квалификационной категории
Проект в сфере экологического волонтерства преподавателя химии первой квалификационной категории Теоретические основы органической химии. Лекция 25
Теоретические основы органической химии. Лекция 25 Соли азотной кислоты – нитраты. Нитриты, Азотные удобрения
Соли азотной кислоты – нитраты. Нитриты, Азотные удобрения Относительная атомная и молекулярная масса
Относительная атомная и молекулярная масса Вклад учёных-химиков в Великую победу
Вклад учёных-химиков в Великую победу Презентация на тему Генетическая связь между классами неорганических вещ-в
Презентация на тему Генетическая связь между классами неорганических вещ-в  Типы кристаллических структур Автор Могилевская А.Е. Санкт-Петербург. ГБОУ СОШ№535
Типы кристаллических структур Автор Могилевская А.Е. Санкт-Петербург. ГБОУ СОШ№535 Основания и кислоты в повседневной жизни
Основания и кислоты в повседневной жизни Диаграммы состояния двухкомпонентных систем типа твердое тело – жидкость
Диаграммы состояния двухкомпонентных систем типа твердое тело – жидкость Агрегатные состояния веществ
Агрегатные состояния веществ Путешествие в страну Металлию. Тест по химии
Путешествие в страну Металлию. Тест по химии Валентность (от латинского valentia – сила)
Валентность (от латинского valentia – сила) 8_ANIONY_2_3_angr
8_ANIONY_2_3_angr h-m-chniy-zv-yazok-budova-rechovin
h-m-chniy-zv-yazok-budova-rechovin Химическое равновесие. Задачи
Химическое равновесие. Задачи Разбор задач
Разбор задач Алкадиены, каучуки
Алкадиены, каучуки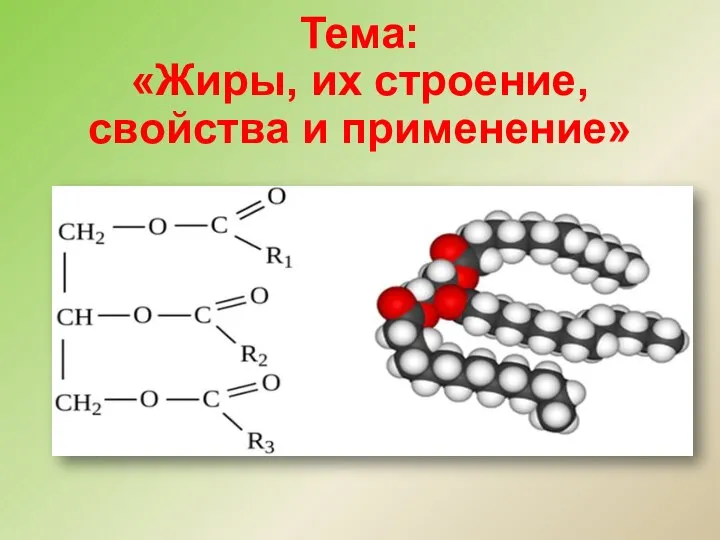 Жиры, их строение, свойства и применение
Жиры, их строение, свойства и применение Классификация оксидов
Классификация оксидов Щелочные металлы
Щелочные металлы Закон Гесса. Термохимические уравнения
Закон Гесса. Термохимические уравнения Комплексные соединения
Комплексные соединения Презентация на тему Растворы (11 класс)
Презентация на тему Растворы (11 класс)  Введение в органическую химию
Введение в органическую химию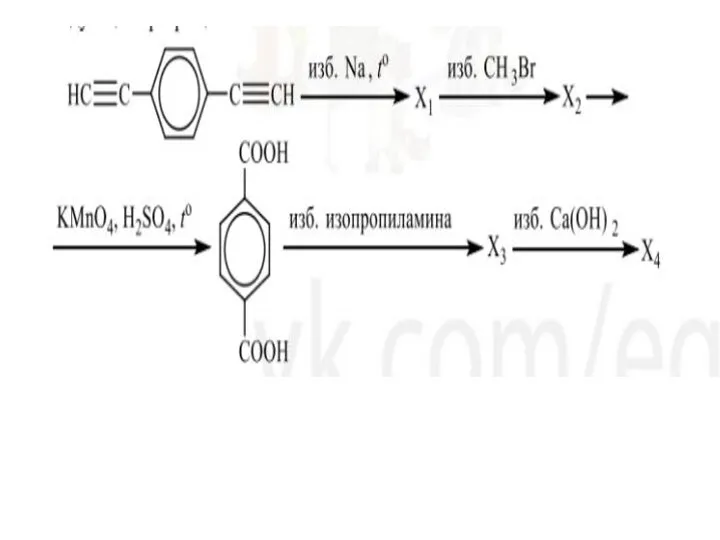 Арены
Арены Составление формул солей
Составление формул солей Молярный объем газов
Молярный объем газов