Содержание
- 2. Пример 1.1. Для элемента железа укажите порядковый номер в периодической системе элементов, атомную массу. Определите число
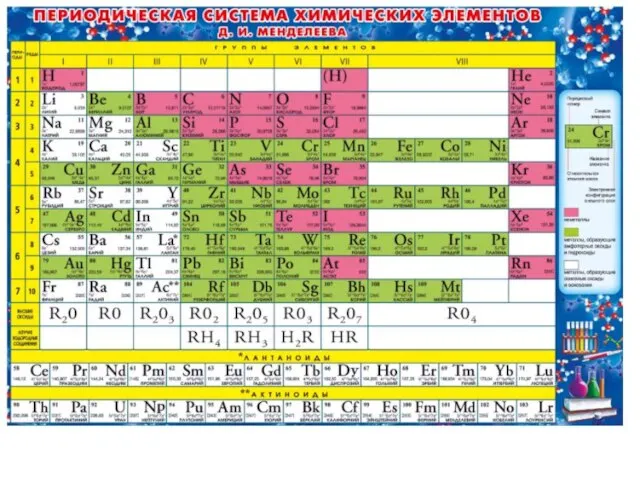
- 4. Решение. По положению железа в периодической системе элементов находим: порядковый номер 26, атомная масса железа Аr
- 5. Порядковый номер элемента равен заряду ядра Z, числу электронов nē, числу протонов nр Отсюда, Z =
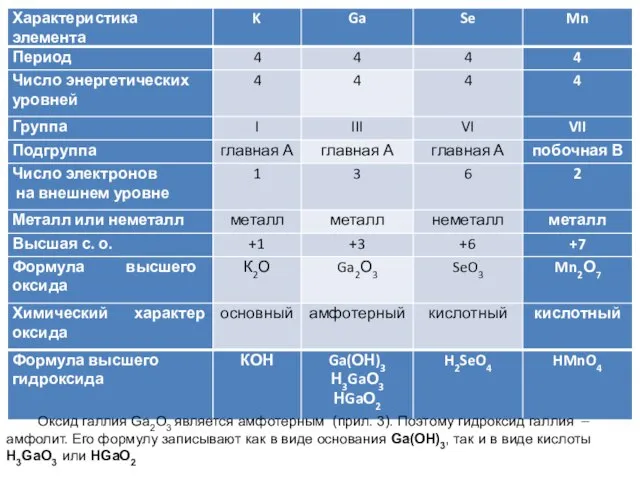
- 6. Пример 1.2. Охарактеризуйте каждый из элементов: селен, калий, галлий, марганец по его положению в периодической системе
- 7. Решение. Период – горизонтальный ряд элементов в периодической системе. Номер периода для элемента равен числу энергетических
- 8. Степень окисления (с. о.) элемента в молекуле – формальный заряд, вычисленный, исходя из предположения, что молекула
- 9. Определим химический характер высшего оксида селена (прил. 2). SeO3 – кислотный оксид, так как селен является
- 10. Оксид галлия Ga2О3 является амфотерным (прил. 3). Поэтому гидроксид галлия – амфолит. Его формулу записывают как
- 11. Тема 2. Основные классы неорганических соединений Пример 2.1. Для приведенных соединений NO2, Mn(OH)3, H2Cr2О7, Al2(SO3)3, (FeOH)2S
- 12. Решение. Степень окисления элементов в соединениях определяется исходя из правил: В оксидах, гидроксидах и солях степень
- 13. В соединении NO2 на два атома кислорода приходится заряд – 4: 2(–2) = –4. Степень окисления
- 14. Пример 2.2. Определите класс приведенных соединений: Cs2O, H3AsO4, Fe(OH)2, CaCO3.
- 15. Решение. Класс соединения определяется его составом и порядком расположения его составных частей Молекула Cs2O состоит из
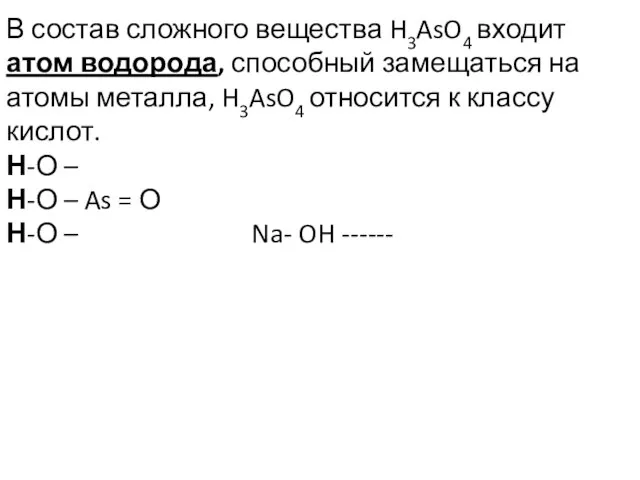
- 16. В состав сложного вещества H3AsO4 входит атом водорода, способный замещаться на атомы металла, H3AsO4 относится к
- 17. В состав сложного вещества Fe(OH)2 входит атом металла и две гидроксильные группы, Fe(OH)2 относится к классу
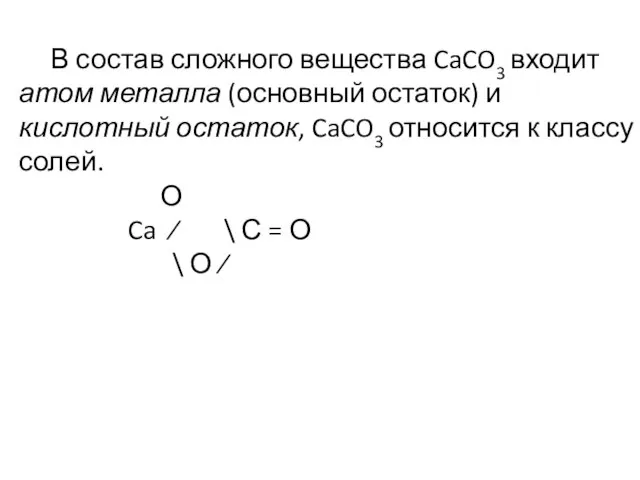
- 18. В состав сложного вещества CaCO3 входит атом металла (основный остаток) и кислотный остаток, CaCO3 относится к
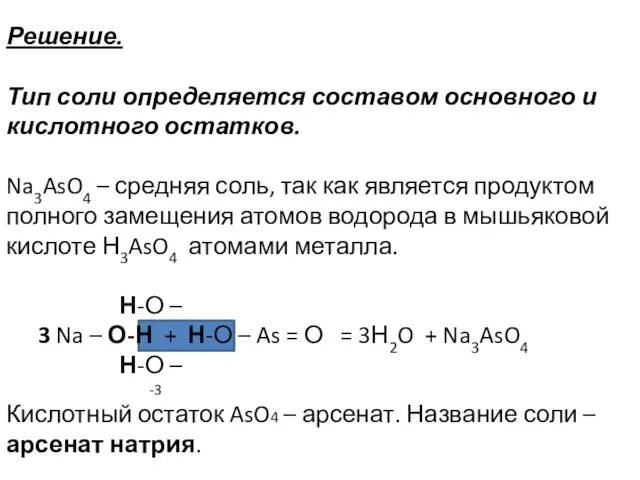
- 19. Пример 2.3. Укажите тип каждой соли (CuOH)2CO3, KHSiO3, Na3AsO4 и назовите их.
- 20. Решение. Тип соли определяется составом основного и кислотного остатков. Na3AsO4 – средняя соль, так как является
- 21. Основные соли содержат две и более гидроксильных групп в основном остатке, их образуют многокислотные основания. Группа
- 22. Кислые соли содержат два и более атомов водорода в кислотном остатке, их образуют многоосновные кислоты. Атом
- 23. Пример 2.4. Назовите оксиды: SeO2, Fe2O3. Укажите их кислотно-основные свойства и подтвердите их химический характер уравнениями
- 24. Решение. Названия оксидов составляют из слова «оксид» и названия химического элемента в родительном падеже. Если элемент
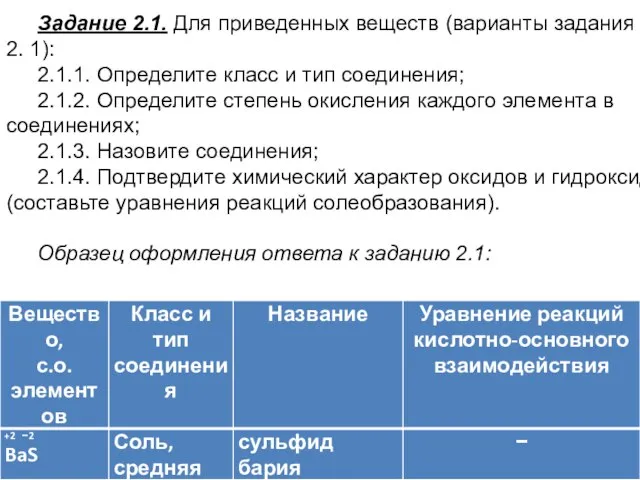
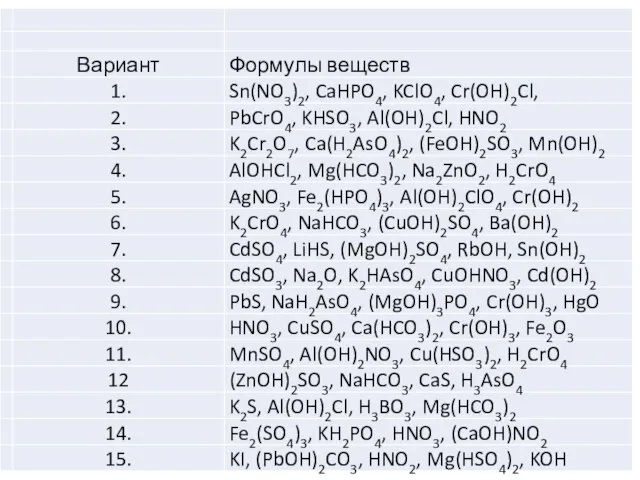
- 25. Задание 2.1. Для приведенных веществ (варианты задания в табл. 2. 1): 2.1.1. Определите класс и тип
- 28. Скачать презентацию


















 Химия и повседневная жизнь человека
Химия и повседневная жизнь человека Химический элемент Li
Химический элемент Li Химия окружающей среды
Химия окружающей среды Строение вещества
Строение вещества Алкины
Алкины Основы химического анализа. Лекция 8
Основы химического анализа. Лекция 8 Цветные опыты
Цветные опыты Анализ саморазряда элементов литий-дисульфид железа
Анализ саморазряда элементов литий-дисульфид железа Химия и производство
Химия и производство Амины. Способы получения
Амины. Способы получения Исследование возможности создания порохов на основе 1,1диамино-2,2-динитроэтилена
Исследование возможности создания порохов на основе 1,1диамино-2,2-динитроэтилена Гетероциклические соединения. Пятичленные гетероциклы с одним гетероатомом
Гетероциклические соединения. Пятичленные гетероциклы с одним гетероатомом Презентация на тему Водород, его общая характеристика, нахождение в природе и его свойства
Презентация на тему Водород, его общая характеристика, нахождение в природе и его свойства  Научный эксперимент в химической технологии
Научный эксперимент в химической технологии Соли. Определение, состав, классификация, физические свойства, применение
Соли. Определение, состав, классификация, физические свойства, применение Алканы
Алканы Реакции ионного обмена, гидролиз солей
Реакции ионного обмена, гидролиз солей Охрана родников Ногликского района и анализ воды из этих родников
Охрана родников Ногликского района и анализ воды из этих родников Химическое равновесие. Принцип Ле Шателье
Химическое равновесие. Принцип Ле Шателье Строение и химический состав костей, рост костей
Строение и химический состав костей, рост костей Типы химических реакций. Реакции разложения, реакции соединения.8 класс
Типы химических реакций. Реакции разложения, реакции соединения.8 класс ЕГЭ по химии: документы, регламентирующие структуру и содержание контрольных измерительных материалов
ЕГЭ по химии: документы, регламентирующие структуру и содержание контрольных измерительных материалов Презентация по Химии "Анилин"
Презентация по Химии "Анилин"  Материаловедение. Модуль
Материаловедение. Модуль Композитные материалы
Композитные материалы Электролиз. Законы Фарадея
Электролиз. Законы Фарадея Типы химических реакций
Типы химических реакций Угольная кислота и её соли
Угольная кислота и её соли