Содержание
- 2. ТЕМА УРОКА: «ОБЩАЯ ХАРАКТЕРИСТИКА НЕМЕТАЛЛОВ»
- 3. НЕМЕТАЛЛЫ - это химические элементы, для атомов которых характерна способность принимать электроны до завершения внешнего уровня.
- 4. 1.НЕМЕТАЛЛЫ Общая характеристика Кислород и кремний составляют 76% от массы земной коры (О – 49%, Si
- 5. НЕМЕТАЛЛЫ Общая характеристика В состав земной атмосферы входят простые и сложные вещества, образованные элементами-неметаллами (N2-75,5%, O2-23,2%,
- 6. 2.РАСПРОСТРАНЕННОСТЬ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ НЕМЕ
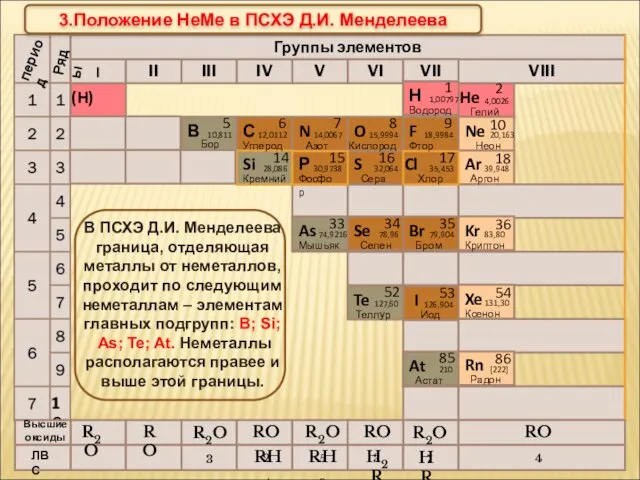
- 7. R2O RO R2O3 RO2 R2O5 RO3 R2O7 RO4 RH4 RH3 H2R HR Высшие оксиды ЛВС 3.Положение
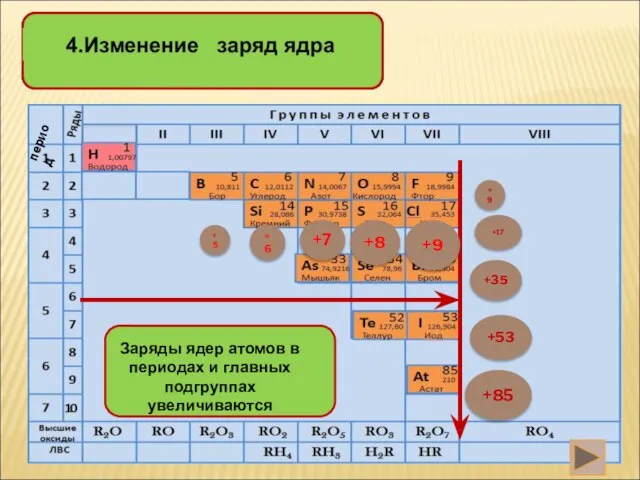
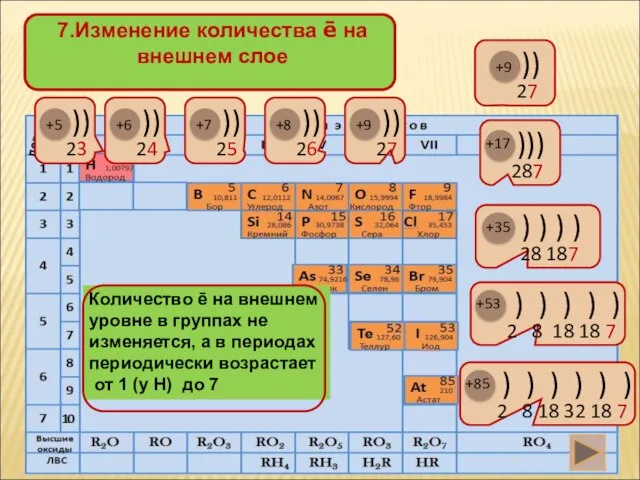
- 8. +5 +6 +7 +8 +9 +85 +17 +9 +53 +35 период
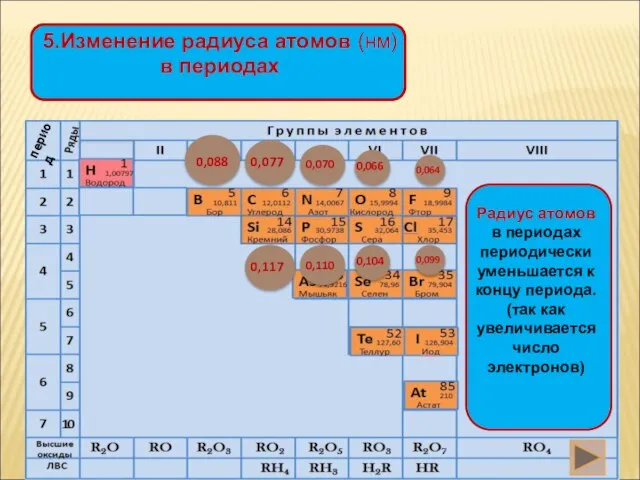
- 9. период
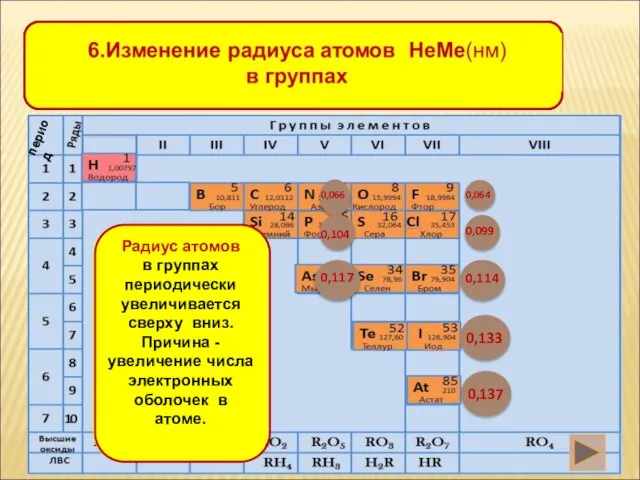
- 10. период
- 11. период
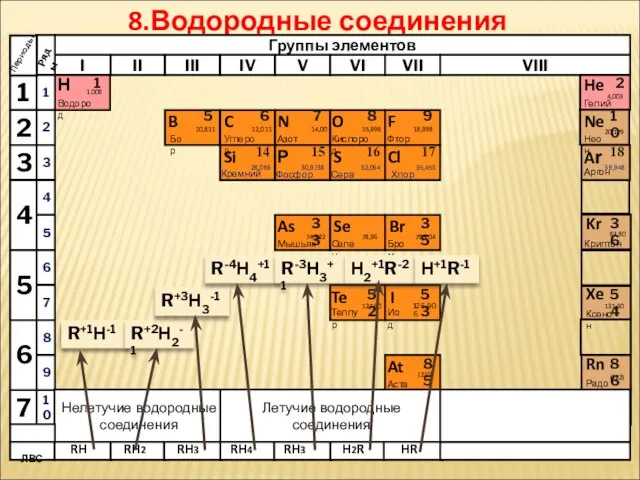
- 12. 8.Водородные соединения НеМе Н Водород 1 1.008 Периоды B C N As He Se Te F
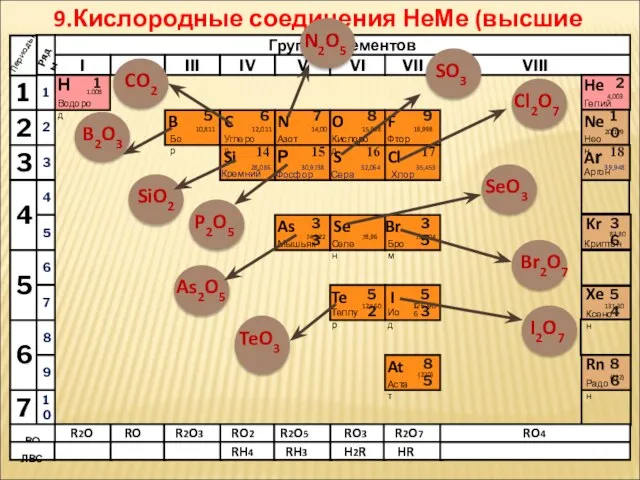
- 13. 9.Кислородные соединения НеМе (высшие оксиды) Н Водород 1 1.008 Периоды B C N As He Se
- 14. 10.Выводы: Изменение св-в НеМе в главной подгруппе: 1.число электронов на внешнем слое не изменяется 2.радиус атома
- 15. 1.Назовите распределение е на оболочках у:серы, фтора, хлора , брома S 2 8 6 F 2
- 16. 11.НАХОЖДЕНИЕ НЕМЕТАЛЛОВ В ПРИРОДЕ В свободном виде НеМе могут быть : Газообразные: Фтор-F₂ , хлор-Cl₂ ,
- 17. Ребята, берегите зрение! Ребята, берегите зрение!
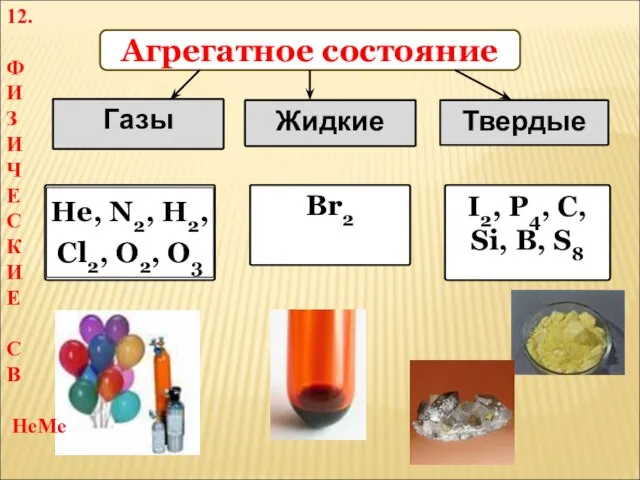
- 18. Агрегатное состояние Газы Жидкие Твердые Br2 I2, P4, C, Si, B, S8 12. Ф И З
- 19. ЦВЕТА НЕМЕТАЛЛОВ БЕЛЫЙ ЧЕРНЫЙ ФОСФОР ФОСФОР ГРАФИТ ЖЕЛТО-ЗЕЛЕНЫЙ ХЛОР
- 20. КРАСНЫЙ ЖЕЛТЫЙ ФИОЛЕТОВЫЙ ФОСФОР СЕРА ЙОД БЕСЦВЕТНЫЙ УГЛЕРОД ЦВЕТА НЕМЕТАЛЛОВ
- 21. Чаще неметаллы находятся в химически связанном виде: вода, минералы, горные породы, различные соли силикаты, фосфаты, сульфиды.
- 22. 1.Какого газа ( по объему) больше всего в атмосфере Земли ? А З О Т А
- 23. Гость из космоса пришел, в воздухе приют себе нашел ВОДОРОД 2.В доме выше всех живем, вдвоем
- 24. 7.Прокаленный уголек дышать пожарнику помог. АКТИВИРОВАННЫЙ УГОЛЬ 8.Белый воздуха боится, покраснел чтоб сохраниться. БЕЛЫЙ И КРАСНЫЙ
- 25. 14.ХИМИЧЕСКИЕ СВОЙСТВА НЕМЕТАЛЛОВ Окислительные свойства простых веществ неметаллов: 1. Реагируют с металлами 2K + S⁰ =
- 26. Самостоятельная работа 1.Допишите уравнения реакций : Na + Br₂ → ? Mg + P → ?
- 27. Самостоятельная работа 2.Допишите уравнения реакций : Si + F₂→ H₂ + WO₃ → Li + N₂
- 28. 1.Неметаллы, расположенные в порядке усиления их неметалличности, - это азот, углерод, бор 2) сера, хлор, фтор
- 29. 3. Ковалентная полярная связь образуется в соединении: 1) NaCl 2) 3) P₄ 4) BaCl₂ 15.Т Е
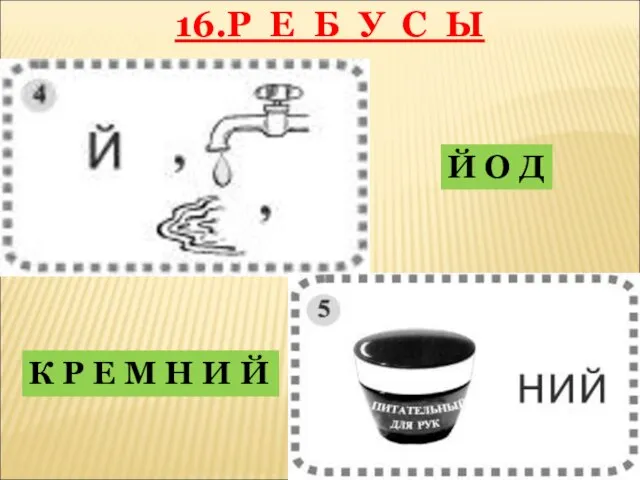
- 30. 16.Р Е Б У С Ы Й О Д К Р Е М Н И Й
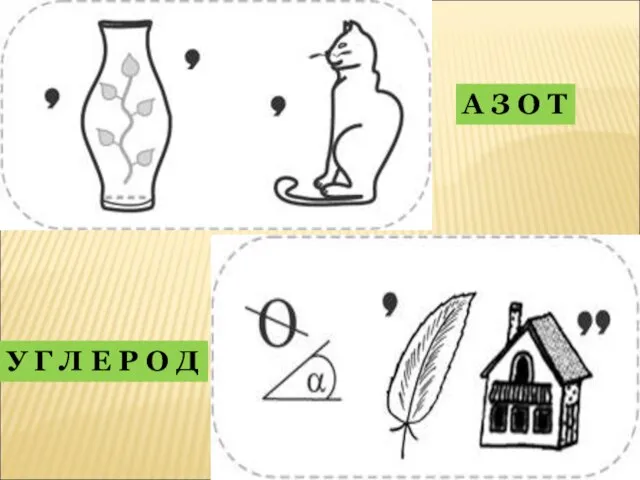
- 31. А З О Т У Г Л Е Р О Д
- 33. Скачать презентацию




















 Методы защиты металлов от электрохимической коррозии. Классификация методов защиты
Методы защиты металлов от электрохимической коррозии. Классификация методов защиты Кроссворд первоначальные понятия
Кроссворд первоначальные понятия Вещество как система. Основы классификации и номенклатуры неорганических веществ
Вещество как система. Основы классификации и номенклатуры неорганических веществ Арены. Бензол
Арены. Бензол Ovr-1
Ovr-1 Турнир знатоков химии
Турнир знатоков химии Классификация методов аналитической химии
Классификация методов аналитической химии 2.Химич. м-ды колич. ан-за
2.Химич. м-ды колич. ан-за Фосфор и его соединения
Фосфор и его соединения Карбоновые кислоты
Карбоновые кислоты Аммиак
Аммиак Химические реакции. Подготовка к контрольной работе №2
Химические реакции. Подготовка к контрольной работе №2 Химическая связь
Химическая связь Исследование коррозии и создание антикоррозийного состава
Исследование коррозии и создание антикоррозийного состава Криогенный разрыв пласта
Криогенный разрыв пласта Презентация по Химии "Строении атомов. Химическая связь"
Презентация по Химии "Строении атомов. Химическая связь"  Особо чистые вещества. Занятие13
Особо чистые вещества. Занятие13 Задачи на ионные равновесия
Задачи на ионные равновесия Основания. Структурная формула
Основания. Структурная формула Хлор. Нахождение в природе
Хлор. Нахождение в природе Презентация на тему Гидролиз солей
Презентация на тему Гидролиз солей  Презентация на тему Использование Икт в преподавании химии
Презентация на тему Использование Икт в преподавании химии  Молекулярная химия
Молекулярная химия Валентность. Нахождение химической формулы вещества по валентности
Валентность. Нахождение химической формулы вещества по валентности Презентация на тему Кристаллы
Презентация на тему Кристаллы  Химические свойства амфотерных оксидов и гидроксидов
Химические свойства амфотерных оксидов и гидроксидов Азотная кислота
Азотная кислота Расчеты по уравнениям химических реакций
Расчеты по уравнениям химических реакций