Слайд 2ПЕРОКСИДЫ ЩЕЛОЧНЫХ МЕТАЛЛОВ ПРЕДСТАВЛЯЮТ СОБОЙ ТВЕРДЫЕ КРИСТАЛЛИЧЕСКИЕ ВЕЩЕСТВА РАЗЛИЧНОГО ЦВЕТА: ПЕРОКСИД ЛИТИЯ-БЕЛОГО, НАТРИЯ

- СЛАБО – ЖЕЛТОГО, КАЛИЯ – РОЗОВОГО.
Слайд 3ИЗ ПЕРОКСИДОВ ЩЕЛОЧНЫХ МЕТАЛЛОВ ПРАКТИЧЕСКОЕ ПРИМЕНЕНИЕ ИМЕЕТ ПЕРЕКИСЬ НАТРИЯ. НА ОКИСЛИТЕЛЬНЫХ СВОЙСТВАХ ОСНОВАНО ИСПОЛЬЗОВАНИЕ

ЕЕ ДЛЯ ОТБЕЛКИ ШЕРСТИ, СОЛОМЫ, ШЕЛКА И ДР. ПЕРЕКИСЬ НАТРИЯ ВХОДИТ В СОСТАВ СТИРАЛЬНЫХ ПОРОШКОВ.
Слайд 4В УЗЛАХ ИОННЫХ КРИСТАЛЛИЧЕСКИХ РЕШЕТОК ПЕРОКСИДОВ ЩЕЛОЧНЫХ МЕТАЛЛОВ M2U2 И НАДПЕРОКСИДОВ МО2 НАХОДЯТСЯ ПЕРОКСИД-ИОНЫ

О2 И НАДПЕРОКСИД-ИОНЫ О2; ИЗВЕСТНЫ И ИОННЫЕ ОЗОНИДЫ СОСТАВА МОЗ. ВСЕ ЭТИ СОЕДИНЕНИЯ ЛЕГКО РАСПАДАЮТСЯ ПРИ НАГРЕВАНИИ С ВЫДЕЛЕНИЕМ КИСЛОРОДА, А ТАКЖЕ ПОДВЕРГАЮТСЯ ГИДРОЛИЗУ С ОБРАЗОВАНИЕМ ГИДРОКСИД-И ГИДРОПЕРОКСИД-ИОНОВ.
Слайд 5ПЕРОКСИД Н § О2 - КРИСТАЛЛЫ; НЕУСТОЙЧИВ, ВЗРЫВАЕТСЯ ПРИ НАГРЕВАНИИ. ПРИ СУХОМ

СПОСОБЕ СИНТЕЗА Н § О СПЛАВЛЯЮТ С ПЕРОКСИДОМ ЩЕЛОЧНОГО МЕТАЛЛА И ПОЛУЧАЮТ БЕСЦВЕТИЕ. ПРИ СЖИГАНИИ ЩЕЛОЧНОЗЕМЕЛЬНЫХ МЕТАЛЛОВ ВСЕГДА ПОЛУЧАЮТСЯ ОКСИДЫ. ПЕРОКСИДЫ, ПОСКОЛЬКУ ОНИ ВООБЩЕ ОБРАЗУЮТСЯ, ГОРАЗДО МЕНЕЕ СТОЙКИ, ЧЕМ ПЕРОКСИДЫ ЩЕЛОЧНЫХ МЕТАЛЛОВ.




 Оборудование и реактивы
Оборудование и реактивы Химия. Введение в предмет (8 класс)
Химия. Введение в предмет (8 класс)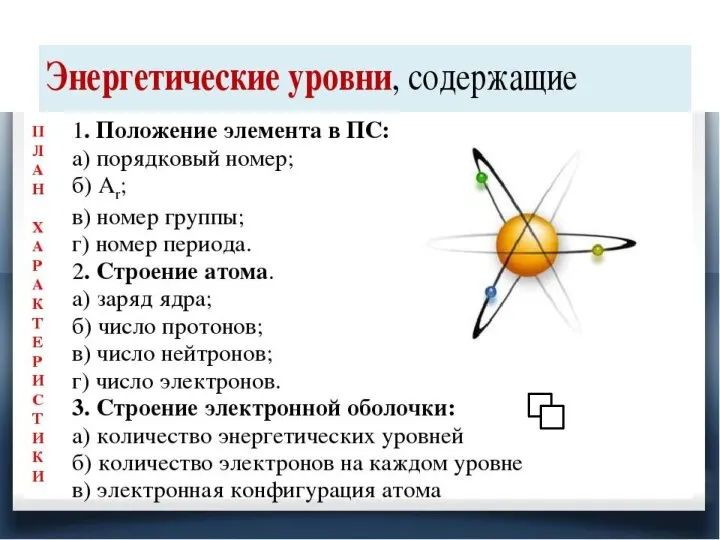 Закономерности изменения свойств атомов химических элементов
Закономерности изменения свойств атомов химических элементов Бутлєров
Бутлєров Методы разделения и очистки веществ
Методы разделения и очистки веществ Алкины. Ацетилен
Алкины. Ацетилен Кислород Общая характеристика, получение и свойства
Кислород Общая характеристика, получение и свойства Получение меди
Получение меди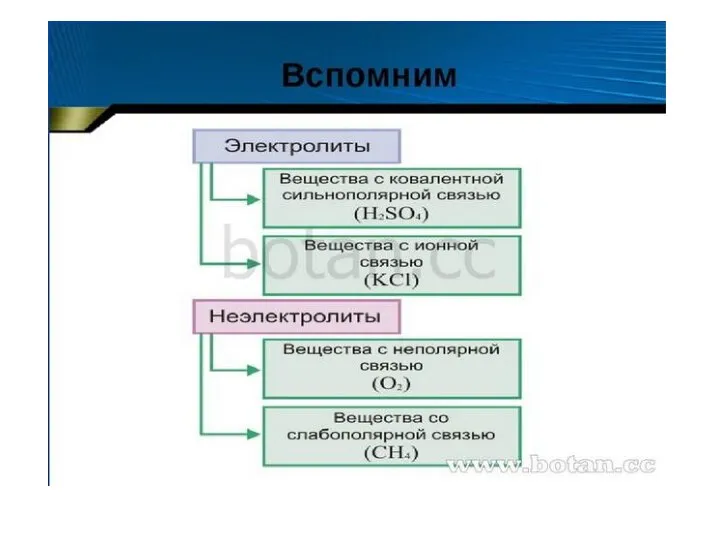 Диссоциация кислот, щелочей солей
Диссоциация кислот, щелочей солей Реализация примерной адаптированной основной общеобразовательной программы по предмету Химия
Реализация примерной адаптированной основной общеобразовательной программы по предмету Химия d-элементы.Распространение в природе и основные материалы
d-элементы.Распространение в природе и основные материалы Примеры карбоновых кислот
Примеры карбоновых кислот Химическая связь и строение вещества
Химическая связь и строение вещества Получение галогеноалканов
Получение галогеноалканов Презентация на тему Алюминий(Al)
Презентация на тему Алюминий(Al)  Полезные ископаемые
Полезные ископаемые Химическое равновесие. Принцип Ле Шателье
Химическое равновесие. Принцип Ле Шателье Предельные углеводороды (алканы)
Предельные углеводороды (алканы) Адиабатическое приближение, потенциальные поверхности молекулярных систем, неадиабатические переходы
Адиабатическое приближение, потенциальные поверхности молекулярных систем, неадиабатические переходы Валентность и ковалентность химической связи
Валентность и ковалентность химической связи Виды химической связи
Виды химической связи Структура материалов. Введение в науку о материалах
Структура материалов. Введение в науку о материалах Алкены
Алкены Галогены. Положение галогенов в ПСХЭ
Галогены. Положение галогенов в ПСХЭ Изменение химмотологических свойств цетанповышающей присадки в процессе хранения
Изменение химмотологических свойств цетанповышающей присадки в процессе хранения Получение функциональных плёнок на основе TiO2
Получение функциональных плёнок на основе TiO2 Синтез и магнитные свойства бис(пиразолил)пиридинового комплекса железа II
Синтез и магнитные свойства бис(пиразолил)пиридинового комплекса железа II Типы химических реакций. 8 класс
Типы химических реакций. 8 класс