Содержание
- 2. Основываясь на принципе минимума свободной энергии, сформулируем условия самопроизвольного протекания процесса в закрытых системах. Условия самопроизвольного
- 3. В химии наиболее часто используется изобарно-изотермический потенциал, поскольку большинство химических (и биологических) процессов происходят при постоянном
- 4. ХИМИЧЕСКОЕ РАВНОВЕСИЕ Протекание самопроизвольного процесса в термодинамической системе сопровождается уменьшением свободной энергии системы (dG 0. Условием
- 5. Изобарно-изотермические (P = const, T = const): ΔG = 0 dG = 0, d2G > 0
- 6. Учение о равновесных состояниях – один из разделов термодинамики. Далее мы будем рассматривать частный случай термодинамического
- 7. Химическое равновесие является динамическим, т.е. соответствует одновременному протеканию процесса в противоположных направлениях с одинаковой скоростью. Химическое
- 8. Любое состояние, смежное с равновесным, является менее устойчивым, и переход в него из состояния равновесия всегда
- 9. Количественной характеристикой химического равновесия является константа равновесия, которая может быть выражена через равновесные концентрации С, парциальные
- 10. Константа равновесия есть характерная величина для каждой обратимой химической реакции; величина константы равновесия зависит только от
- 11. Химический потенциал. Введем ещё одно понятие - химический потенциал. Величина свободной энергии системы зависит как от
- 12. Введем в некоторую систему бесконечно малое количество dni молей i-го компонента; - это вызовет бесконечно малое
- 13. Химический потенциал компонента связан с его парциальным давлением или концентрацией следующими соотношениями: μi = μ°i +
- 14. Поскольку условием равновесия является минимум свободной энергии системы (dG = 0, dF = 0), можно записать:
- 15. Отсюда можно получить следующее условие химического равновесия в закрытой системе: В общем виде условие химического равновесия:
- 16. Поскольку Σniμi = ΔF, а Σniμ°i = ΔF°, получаем: Для изобарно-изотермического процесса аналогичным образом можно получить:
- 17. Поскольку для каждой химической реакции стандартное изменение термодинамического потенциала ΔF° и ΔG° есть строго определенная величина,
- 18. Уравнения показывают связь константы равновесия со стандартным изменением свободной энергии в ходе реакции. Уравнение изотермы химической
- 19. Знак ΔG (ΔF) определяет возможность самопроизвольного протекания процесса в системе. При этом ΔG° (ΔF°) равно изменению
- 20. Если изменение термодинамического потенциала меньше нуля, процесс в данных условиях будет протекать самопроизвольно.
- 21. Влияние внешних условий на химическое равновесие При постоянстве внешних условий система может находиться в состоянии равновесия
- 22. Влияние давления и концентрации 1. В систему добавлено исходное вещество. В этом случае По уравнению изотермы
- 23. 2. В систему добавлен продукт реакции. В этом случае Согласно уравнению изотермы химической реакции, ΔF >
- 24. 3. Изменено общее давление (для реакций в газовой фазе). Парциальные давления всех компонентов Рi в этом
- 25. Примем, что Р2 > Р1. В этом случае, если Δn > 0 (реакция идет с увеличением
- 26. Увеличение общего давления смещает равновесие в сторону процесса, идущего с уменьшением числа молей газообразных веществ. Уменьшение
- 27. Изменение концентрации или давления, смещая равновесие, не изменяет величину константы равновесия, которая зависит только от природы
- 28. Влияние температуры на положение равновесия Повышение либо понижение температуры означает приобретение (+) либо потерю (-) системой
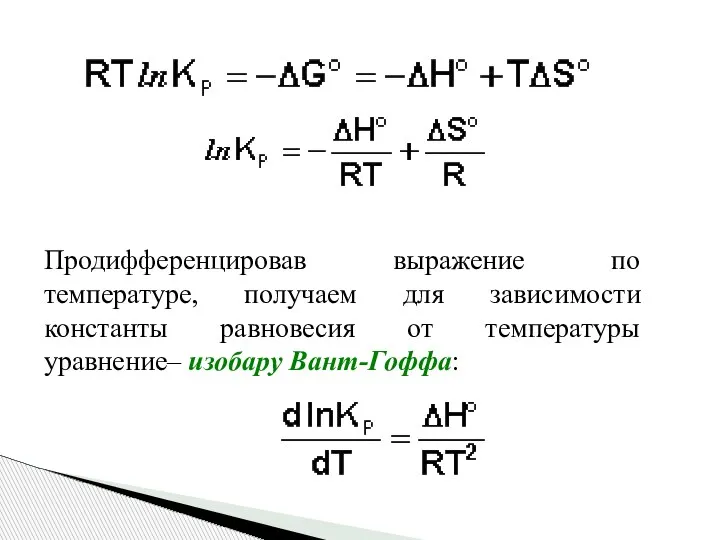
- 29. Продифференцировав выражение по температуре, получаем для зависимости константы равновесия от температуры уравнение– изобару Вант-Гоффа:
- 30. Аналогично, для процесса, проходящего в изохорных условиях, можно получить изохору Вант-Гоффа:
- 31. Изобара и изохора Вант-Гоффа связывают изменение константы химического равновесия с тепловым эффектом реакции в изобарных и
- 32. Экзотермические реакции: ΔH° Эндотермические реакции: ΔH° > 0 (ΔU° > 0). В этом случае температурный коэффициент
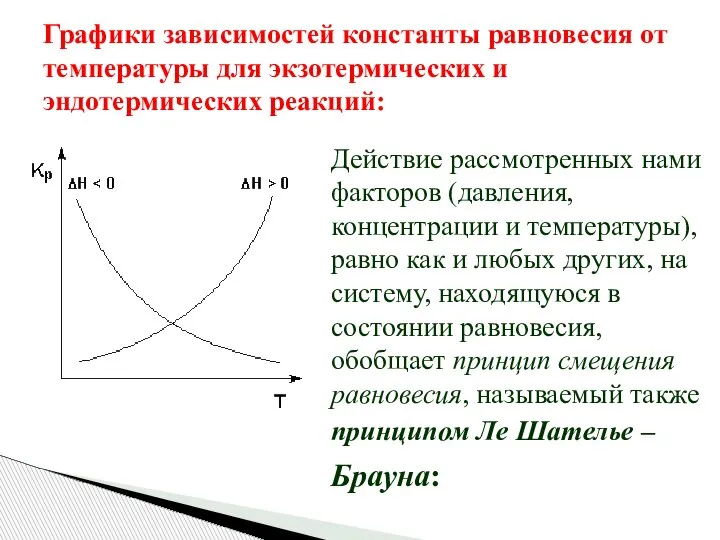
- 33. Графики зависимостей константы равновесия от температуры для экзотермических и эндотермических реакций: Действие рассмотренных нами факторов (давления,
- 35. Скачать презентацию






























 Металлы и их соединения
Металлы и их соединения Классы неорганических соединений
Классы неорганических соединений Степени окисления
Степени окисления Презентация на тему Химические средства гигиены и косметика
Презентация на тему Химические средства гигиены и косметика  Сложные эфиры
Сложные эфиры Презентация на тему Теория электролитической диссоциации.
Презентация на тему Теория электролитической диссоциации.  Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Фосфор – химический элемент
Фосфор – химический элемент Дисперсные системы и поверхностные явления
Дисперсные системы и поверхностные явления Неметаллы
Неметаллы Значимые личности в химии
Значимые личности в химии Массовая доля химич элемента
Массовая доля химич элемента Способы получения металлов
Способы получения металлов Блок колонн на установке замедленного коксования производительностью 730000 тонн/год гудрона (поз.к-1, кх-1)
Блок колонн на установке замедленного коксования производительностью 730000 тонн/год гудрона (поз.к-1, кх-1) Презентация на тему Металлическая связь
Презентация на тему Металлическая связь  10_KhimiaKlassifikatsia_organicheskikh_soedieniy (1)
10_KhimiaKlassifikatsia_organicheskikh_soedieniy (1) Относительная молекулярная массa. Химический диктант
Относительная молекулярная массa. Химический диктант Металлы. Тестирование
Металлы. Тестирование 9-14 Реакции в растворах электролитов
9-14 Реакции в растворах электролитов Классификация углеводов: моносахариды, дисахариды, полисахариды. Химическая структура. Свойства и функция углеводов
Классификация углеводов: моносахариды, дисахариды, полисахариды. Химическая структура. Свойства и функция углеводов Презентация на тему Золото
Презентация на тему Золото  Энергетический обмен
Энергетический обмен Химическая связь и строение молекул
Химическая связь и строение молекул Строение атома. История открытия
Строение атома. История открытия Чугуны
Чугуны Соли аммония
Соли аммония Нафтены и арены
Нафтены и арены Соединения азота
Соединения азота