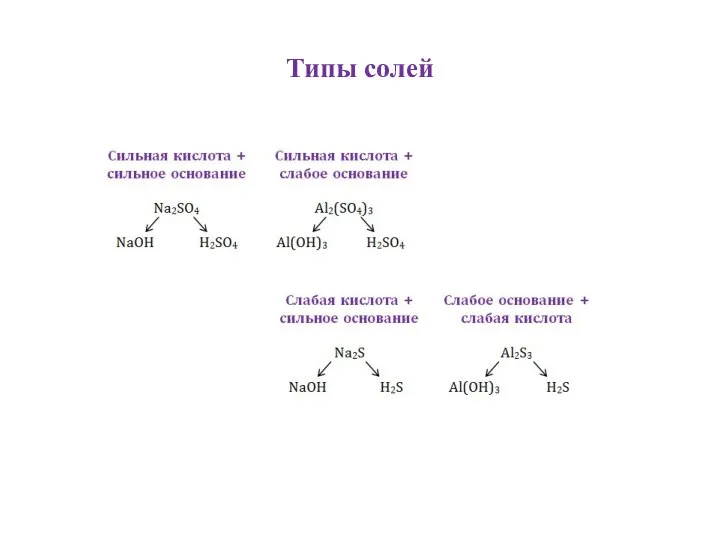
Слайд 5Сильные основания Сильные кислоты
Правило Полинга
HaXOb
b – a = 0 или 1 – слабая
b

– a = 2 или 3 – сильная
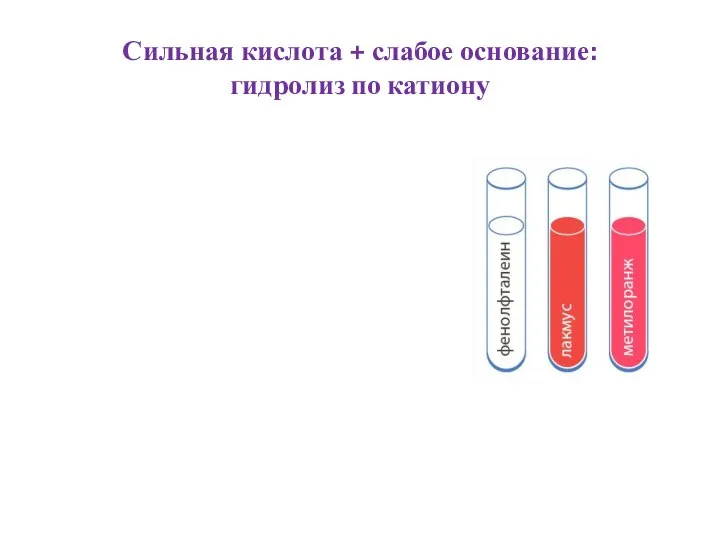
Слайд 6Сильная кислота + слабое основание:
гидролиз по катиону
Слайд 7Слабая кислота + сильное основание:
гидролиз по аниону
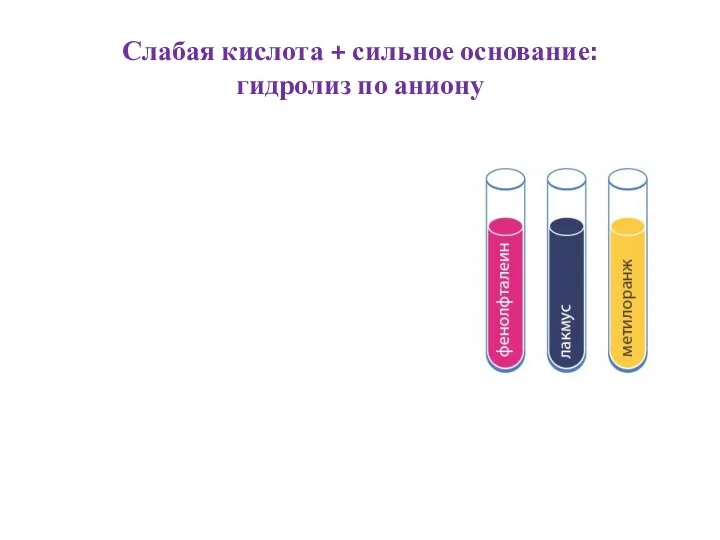
Слайд 8Слабая кислота + слабое основание:
гидролиз по аниону и по катиону
Существующие соли
Некоторые

«?» и «–» соли
Слайд 9Ловушки в тестах
«Н» соли не гидролизуются

Слайд 10Ловушки в тестах
среда растворов кислых солей активных металлов:
кислая щелочная
HSO4–, H2PO4– HS –, HCO3–, HPO42–…

Слайд 18Совместный гидролиз в заданиях ЕГЭ
№ 32. Оксид железа (III) растворили в соляной

кислоте. К полученному раствору добавили карбонат калия. Выпавший осадок отделили и прокалили. Над полученным веществом пропустили водород при нагревании.
Слайд 19Совместный гидролиз в заданиях ЕГЭ
№ 32. Натрий растворили в воде. Через полученный

раствор пропустили недостаток сернистого газа, а затем добавили бромид алюминия. Выпавший осадок отделили и прокалили.
Слайд 20Совместный гидролиз в заданиях ЕГЭ

















 Кремний и его соединения
Кремний и его соединения Химические элементы
Химические элементы Соли. Определение, состав, классификация, физические свойства, применение
Соли. Определение, состав, классификация, физические свойства, применение Введение в органическую химию. Состав и структура органических веществ
Введение в органическую химию. Состав и структура органических веществ Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Каучук. Строение и применение
Каучук. Строение и применение Загадочный фосфор
Загадочный фосфор Logo кроссворд первоначальные понятия. 8 класс
Logo кроссворд первоначальные понятия. 8 класс металлы
металлы Физические свойства минералов
Физические свойства минералов Серная кислота и ее соли
Серная кислота и ее соли Химические реакции
Химические реакции Презентация на тему Вычисления массовой доли растворенного вещества
Презентация на тему Вычисления массовой доли растворенного вещества  Введение в дисциплину Процессы и аппараты химической технологии
Введение в дисциплину Процессы и аппараты химической технологии Кремний – химический элемент или природный дар
Кремний – химический элемент или природный дар Хром
Хром Вода знакомая и не знакомая
Вода знакомая и не знакомая Башня плотности
Башня плотности Классификация реакций. Теория-кинетика
Классификация реакций. Теория-кинетика Марганец. Химия элементов. Кислородосодержащие соединения
Марганец. Химия элементов. Кислородосодержащие соединения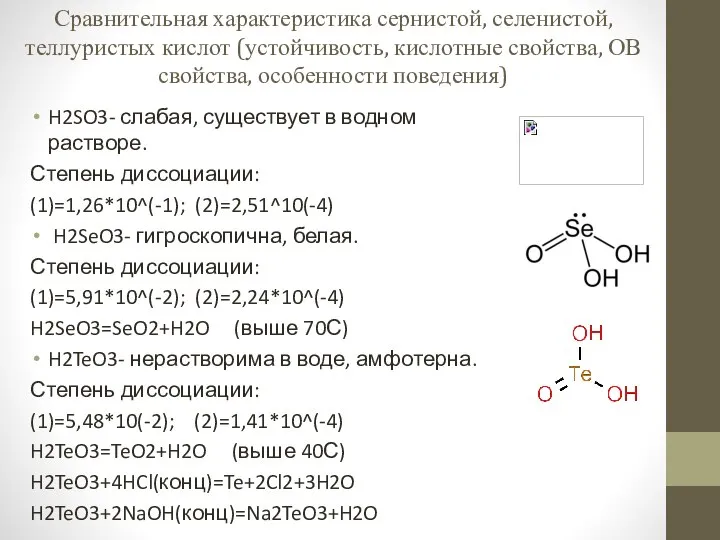 Сравнительная характеристика сернистой, селенистой, теллуристых кислот
Сравнительная характеристика сернистой, селенистой, теллуристых кислот Химия в быту
Химия в быту Решение экспериментальных задач по теме Подгруппы азота и углерода
Решение экспериментальных задач по теме Подгруппы азота и углерода Спирты. Методы получения
Спирты. Методы получения Теория радиационной деформации в некубических металлах: явление анизотропной диффузии
Теория радиационной деформации в некубических металлах: явление анизотропной диффузии Автоматизация процесса сушки миксера печи СКН
Автоматизация процесса сушки миксера печи СКН Скорость химической реакции
Скорость химической реакции Лабораторное оборудование. Тесты
Лабораторное оборудование. Тесты