Содержание
- 2. Вспомните, какие вещества мы называем углеводородами? УГЛЕВОДОРОДЫ – это органические соединения, состоящие из двух химических элементов
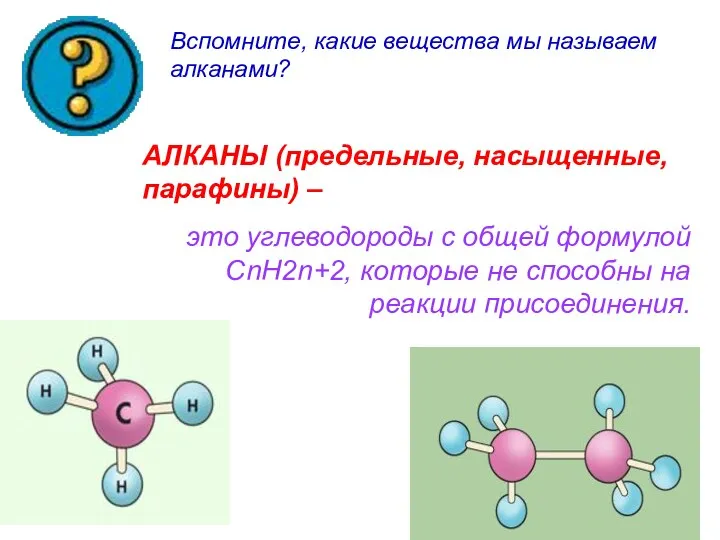
- 3. Вспомните, какие вещества мы называем алканами? АЛКАНЫ (предельные, насыщенные, парафины) – это углеводороды с общей формулой
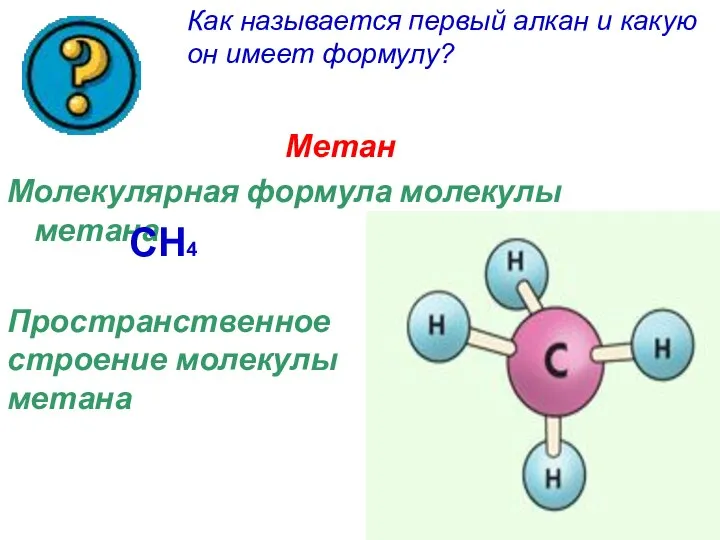
- 4. Метан Молекулярная формула молекулы метана CH4 Пространственное строение молекулы метана Как называется первый алкан и какую
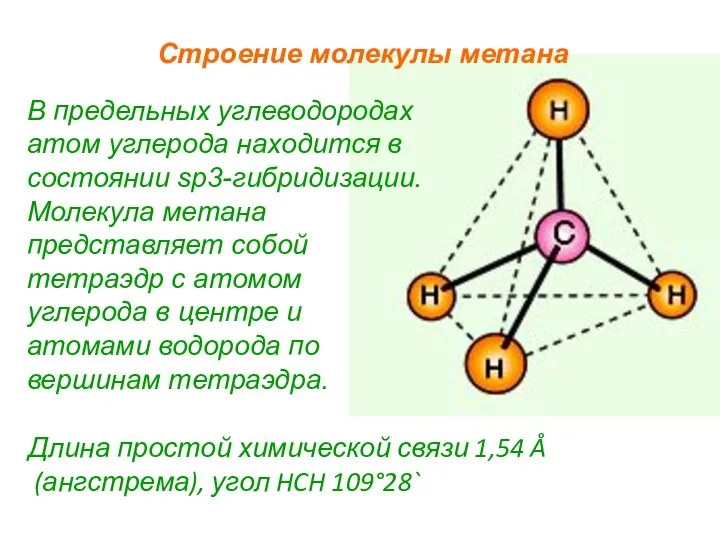
- 5. Длина простой химической связи 1,54 Å (ангстрема), угол HCH 109°28` В предельных углеводородах атом углерода находится
- 7. Тема урока «Физические и химические свойства алканов» Определение углеводородов Определение алканов Номенклатура алканов Физические свойства Химические
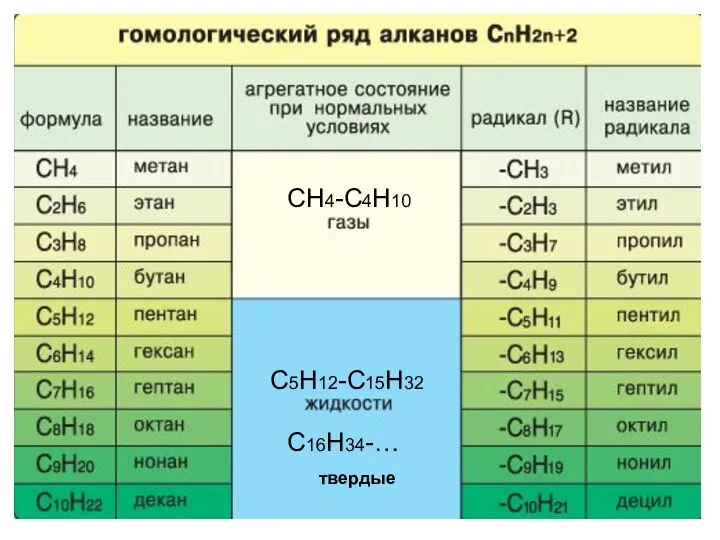
- 8. ГОМОЛОГИЧЕСКИЙ РЯД АЛКАНОВ Вспомните, какие вещества мы называем гомологами? ГОМОЛОГИ – это вещества со схожими строением
- 9. СН4-С4Н10 С5Н12-С15Н32 С16Н34-… твердые
- 10. Физические свойства Температуры плавления и кипения увеличиваются с молекулярной массой и длиной главной углеродной цепи При
- 11. ФИЗИЧЕСКИЕ СВОЙСТВА АЛКАНОВ. МЕТАН – газ, без цвета и запаха, почти в 2 раза легче воздуха,
- 12. ЭТАН, ПРОПАН И БУТАН входят в состав природного и попутного нефтяного газов. АЛКАНЫ содержатся в нефти.
- 13. Химические свойства В обычных условиях алканы химически инертны. Они устойчивы к действию многих реагентов: не взаимодействуют
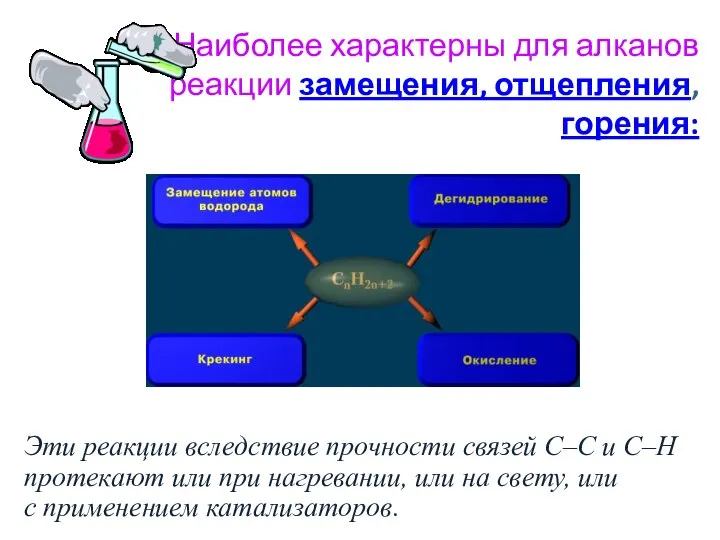
- 14. Наиболее характерны для алканов реакции замещения, отщепления, горения: Эти реакции вследствие прочности связей C–C и C–H
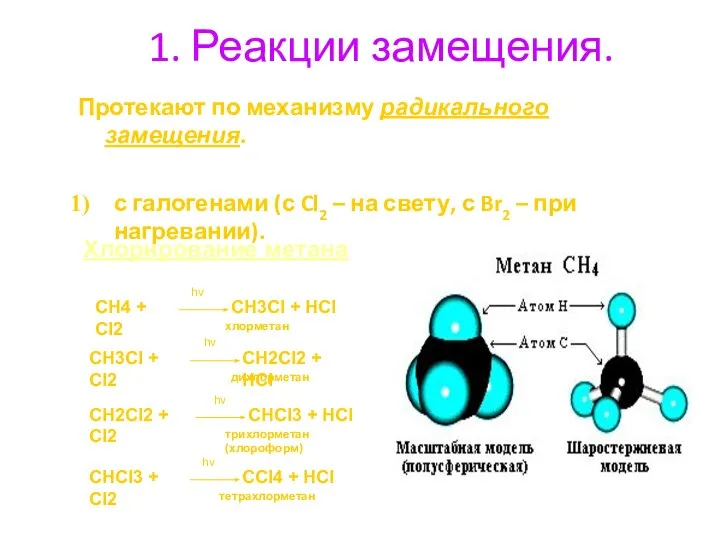
- 15. 1. Реакции замещения. Протекают по механизму радикального замещения. с галогенами (с Cl2 – на свету, с
- 16. Реакции галогенирования –замещение атома водорода атомом галогена. Замещение атома водорода галогеном легче всего идет у менее
- 17. CH4 + Cl2 → CH3Cl + HCl CH3Cl + Cl2 → CH2Cl2 + HCl CH2Cl2 +
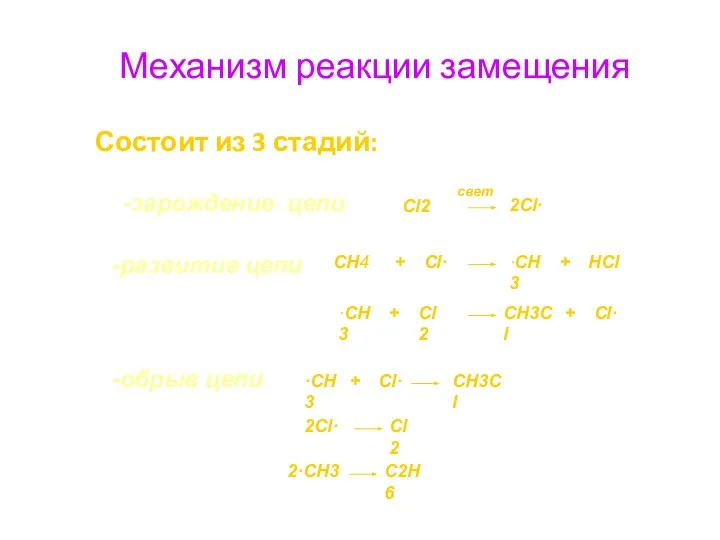
- 18. Механизм реакции замещения Состоит из 3 стадий: -зарождение цепи Cl2 2Cl· -развитие цепи CH4 + Cl·
- 19. Перед нами типичная цепная реакция… Теоретически хлорирование метана может идти до бесконечности, т.е. до тех пор
- 20. Запишите определение! Реакции, в результате которых происходит цепь последовательных превращений, называют цепными реакциями. (стр. 24)
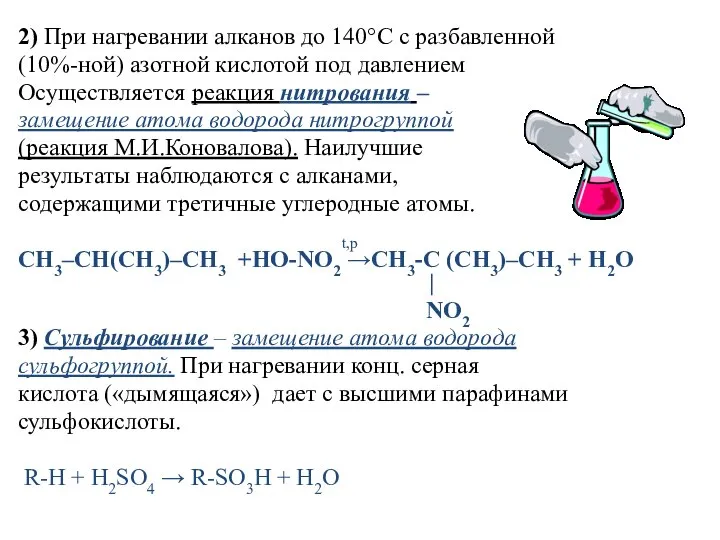
- 21. 2) При нагревании алканов до 140°С с разбавленной (10%-ной) азотной кислотой под давлением Осуществляется реакция нитрования
- 22. Запомните! Для алканов характерны реакции замещения атомов водорода на другие атомы или группы атомов. В этих
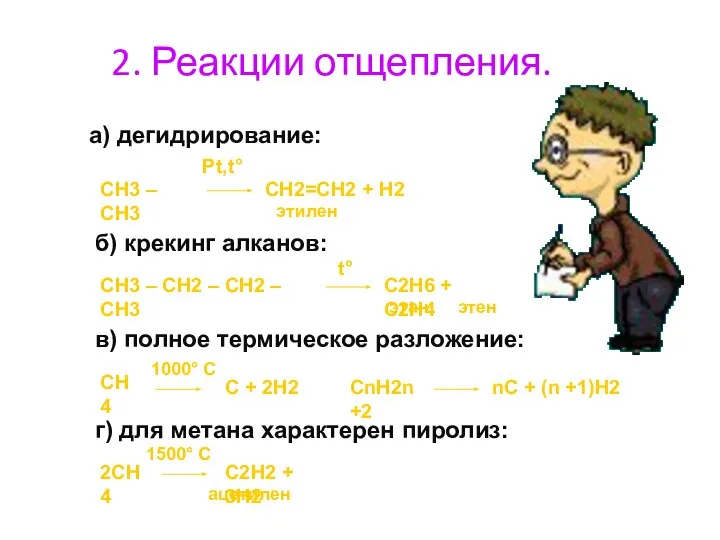
- 23. 2. Реакции отщепления. а) дегидрирование: CH3 – CH3 Pt,t° CH2=CH2 + H2 б) крекинг алканов: CH3
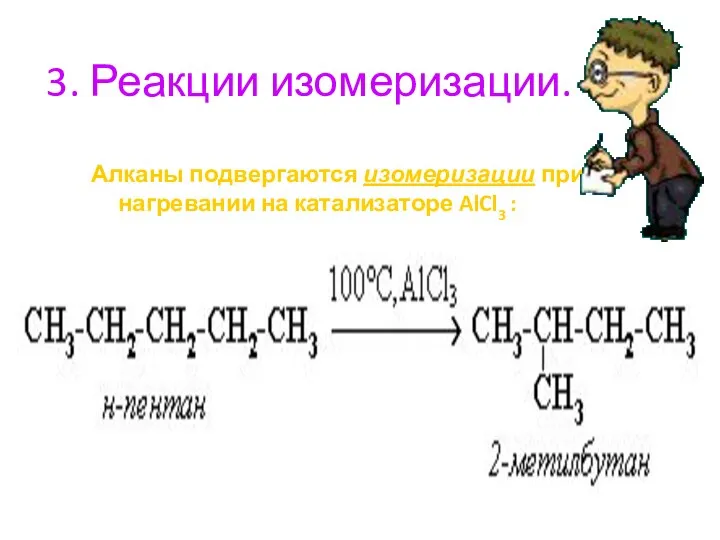
- 24. 3. Реакции изомеризации. Алканы подвергаются изомеризации при нагревании на катализаторе AlCl3 :
- 25. 4. Реакции окисления. а) все алканы горят с образованием углекислого газа и воды : б) при
- 26. Взрыв метана с кислородом Для полного сгорания метана на один объем метана нужно взять два объема
- 28. Запомните! Алканам характерны следующие химические реакции: 1. Реакции замещения; 2. Реакции отщепления; 3. Реакции изомеризации; 4.
- 29. Вопросы для самопроверки
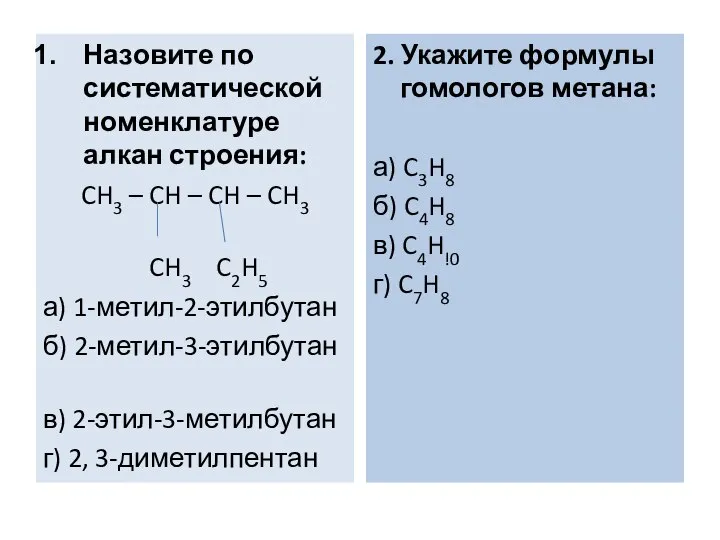
- 30. Назовите по систематической номенклатуре алкан строения: CH3 – CH – CH – CH3 CH3 C2H5 а)
- 31. 3. Каким соединениям даны неправильные названия? а) 2-метилпентан б) 2-этилбутан в) 1-метилпентан г) диметилбутан 4. Какое
- 32. 5. Какие характеристики применимы для описания реакции хлорирования этана? а) цепная б) свободнорадикальная в) протекает в
- 33. 7. В отличие от пропана бутан вступает в реакцию: а) горения в кислороде б) хлорирования при
- 34. Выставляем оценки Оценка «5» – Выполнено: 7 - 8 з.; Оценка «4» – Выполнено: 5 -
- 36. Скачать презентацию





















 Вуглеводи
Вуглеводи Производство серной кислоты
Производство серной кислоты Применение некоторых химических веществ. Задание 1
Применение некоторых химических веществ. Задание 1 Понятие об ароматических спиртах и фенолах. Особенности строения фенола
Понятие об ароматических спиртах и фенолах. Особенности строения фенола Использование катионных красителей в экстракционно-флуориметрическом анализе
Использование катионных красителей в экстракционно-флуориметрическом анализе Ювелирные камни
Ювелирные камни Общая характеристика криптона
Общая характеристика криптона Презентация на тему Алкены. Строение. Изомерия. Химические свойства. Получение
Презентация на тему Алкены. Строение. Изомерия. Химические свойства. Получение  Реакцияға қабілетті олигомерлердің мономерлерге қарағанда артықшылығы
Реакцияға қабілетті олигомерлердің мономерлерге қарағанда артықшылығы Триметилалюминий
Триметилалюминий Презентация на тему Знаешь ли ты классы неорганических веществ
Презентация на тему Знаешь ли ты классы неорганических веществ  атомно-молекулярное учение (1)
атомно-молекулярное учение (1) Основания. Определение. Формулы
Основания. Определение. Формулы Природные кристаллы
Природные кристаллы Свойства кремниевой кислоты и области применения силикатов
Свойства кремниевой кислоты и области применения силикатов Физическая химия, термодинамика
Физическая химия, термодинамика теория строения
теория строения Агрегатные состояния веществ
Агрегатные состояния веществ Минералы. Внутренняя структура минералов
Минералы. Внутренняя структура минералов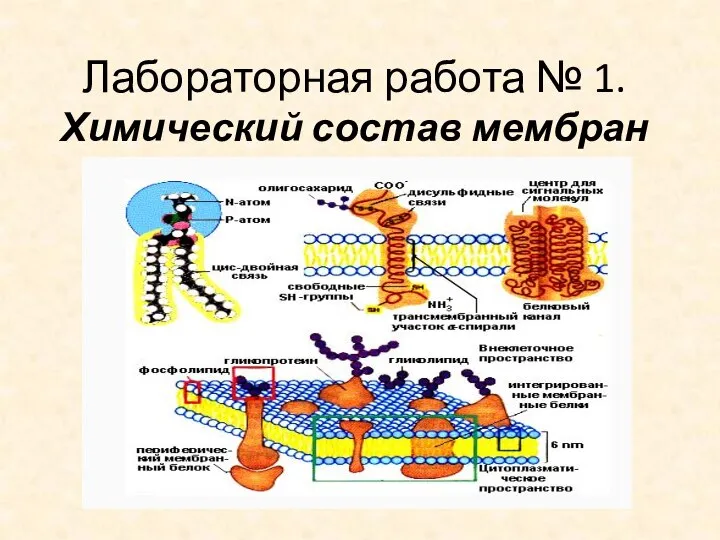 Химический состав мембран. Лабораторная работа № 1
Химический состав мембран. Лабораторная работа № 1 Физико-химические методы анализа. Лекция № 1
Физико-химические методы анализа. Лекция № 1 кремний и его соединения
кремний и его соединения Презентация на тему Теория строения химических соединений А.М.Бутлерова
Презентация на тему Теория строения химических соединений А.М.Бутлерова  ЛК 2_окислительно-восстановительные процессы
ЛК 2_окислительно-восстановительные процессы Интерактивный плакат Алканы
Интерактивный плакат Алканы Алканы. Строение и изомерия
Алканы. Строение и изомерия Основания. Классификация
Основания. Классификация Степень окисления
Степень окисления