Современная теория строения атома. Периодический закон и периодическая система элементов Д.И. Менделеева
Содержание
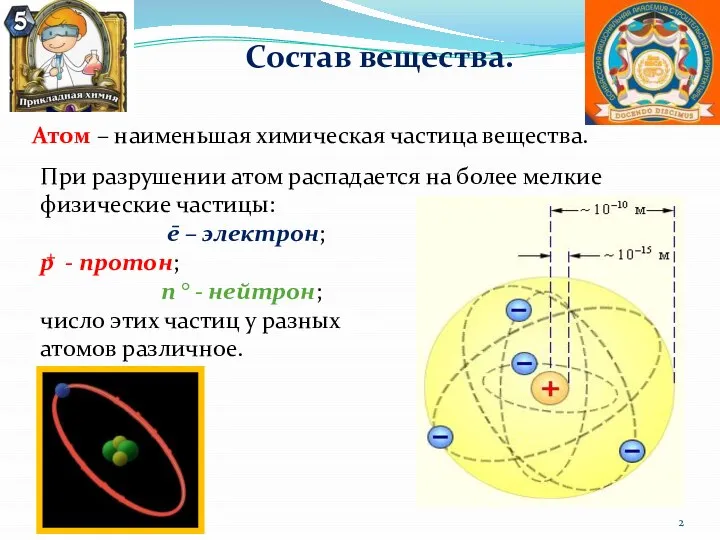
- 2. Состав вещества. Атом – наименьшая химическая частица вещества. При разрушении атом распадается на более мелкие физические
- 4. Строение электронной оболочки атома Атомная орбиталь - состояние электрона в атоме. Каждой орбитали соответствует электронное облако.
- 5. Квантовые числа: Главное квантовое число n определяет уровень энергии, которому отвечает данная орбита, и ее удаленность
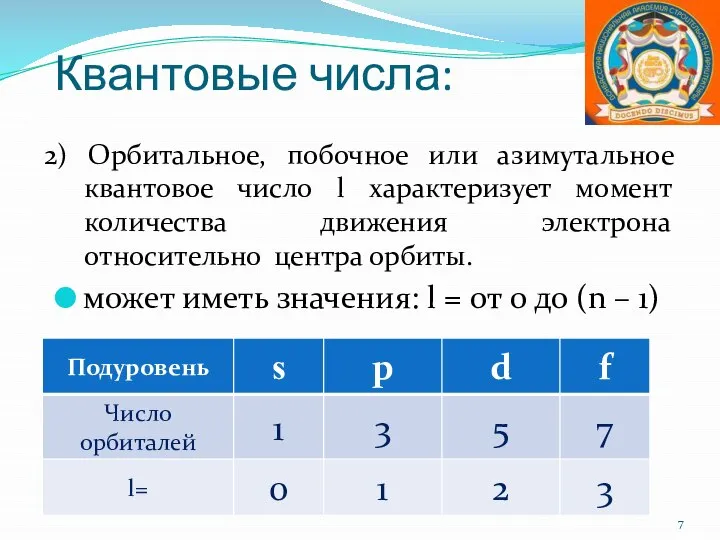
- 7. Квантовые числа: 2) Орбитальное, побочное или азимутальное квантовое число l характеризует момент количества движения электрона относительно
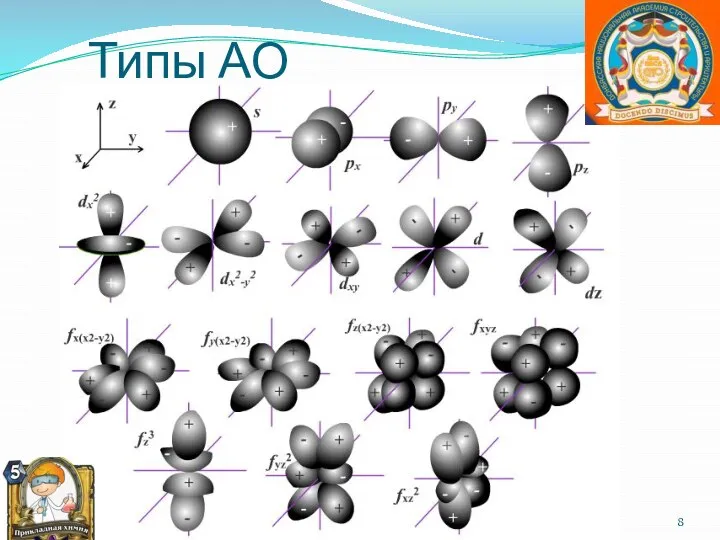
- 8. Типы АО
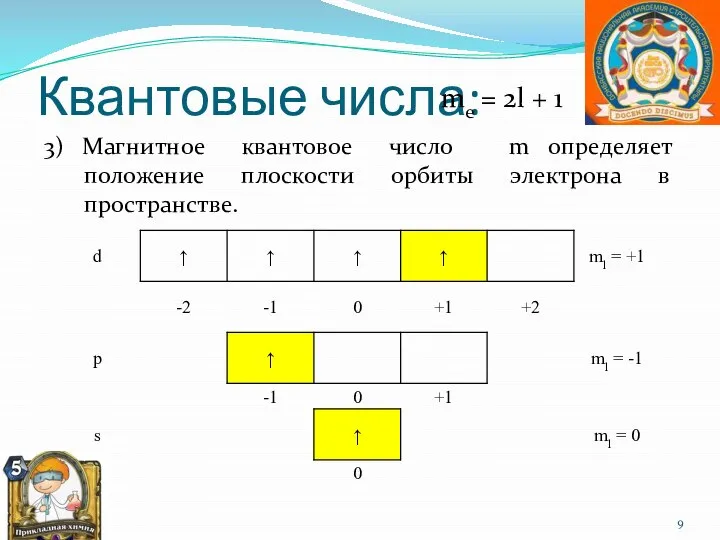
- 9. Квантовые числа: 3) Магнитное квантовое число m определяет положение плоскости орбиты электрона в пространстве. mе =
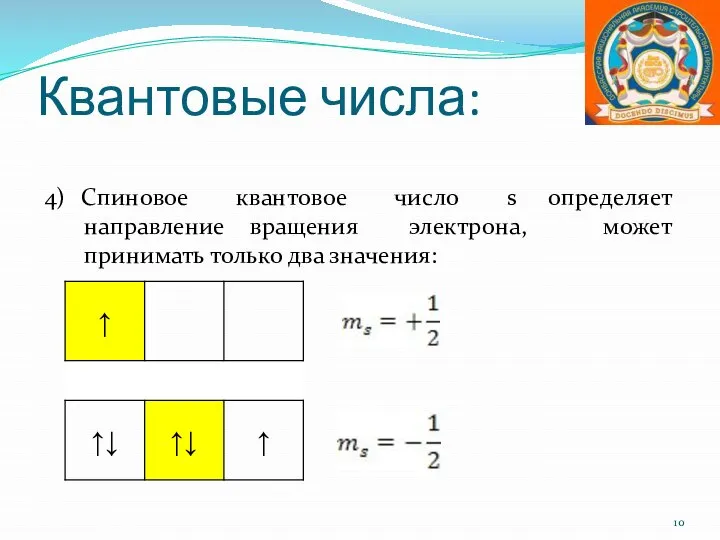
- 10. Квантовые числа: 4) Спиновое квантовое число s определяет направление вращения электрона, может принимать только два значения:
- 11. Принцип наименьшей энергии Электроны заполняют орбитали в порядке возрастания энергии орбиталей.
- 12. Принцип Паули В атоме не может быть двух электронов, у которых все четыре квантовых числа были
- 13. Правило Хунда Заполнение орбиталей с одинаковым значением l (подуровни) отвечают принципу максимальной мультиплетности – одному из
- 14. Правила Клечковского 1. Первым заполняется тот подуровень, для которого сумма главного квантового числа (n) и орбитального
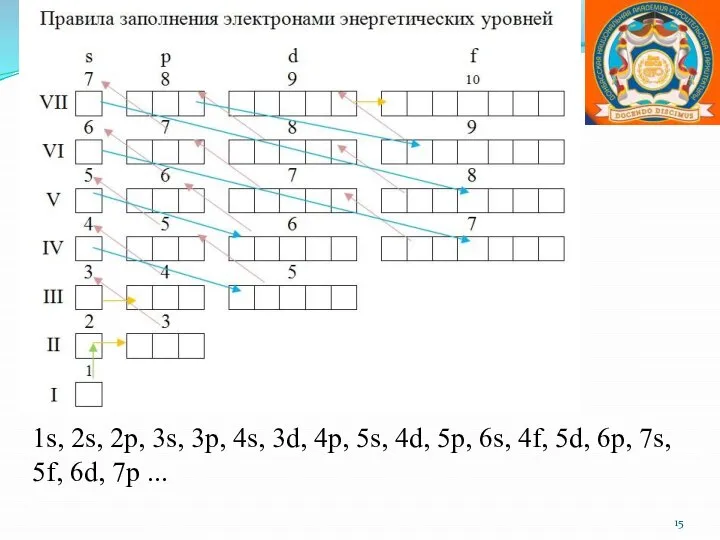
- 15. 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s,
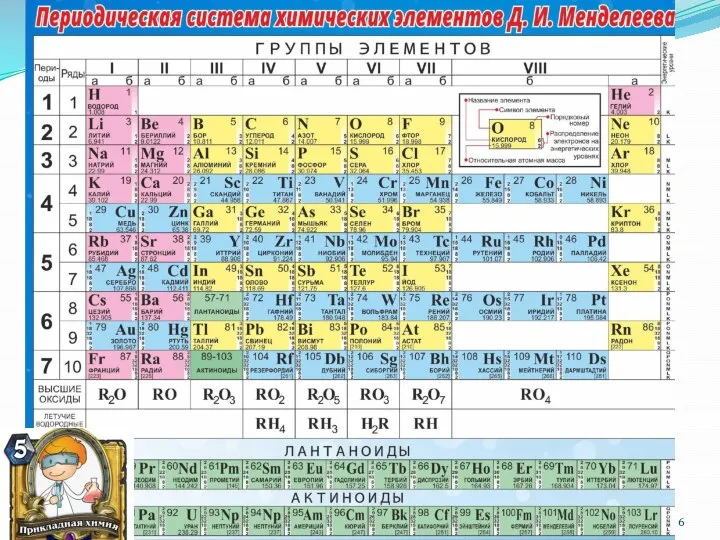
- 16. Периодический закон Свойства элементов (физические и химические), а также их простых соединений находятся в периодической зависимости
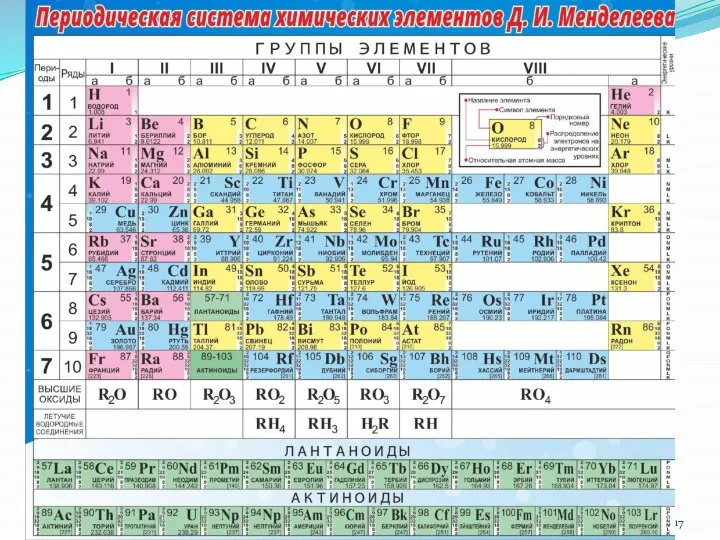
- 18. Структура «короткопериодной» периодической системы элементов Период – горизонтальный ряд элементов, начинающийся щелочным металлом и заканчивающийся инертным
- 19. 1. Порядковый номер элемента равен заряду ядра атома, а значит равен числу протонов в ядре и
- 20. Для элементов главных подгрупп: равно номеру группы Для элементов побочных подгрупп: как правило = 2 Исключения:
- 21. Закономерности изменения свойств химических элементов и образованных ими простых веществ в периоде радиус атомов уменьшается; восстановительные
- 22. Закономерности изменения свойств химических элементов и образованных ими простых веществ в группе радиус атомов увеличивается; восстановительные
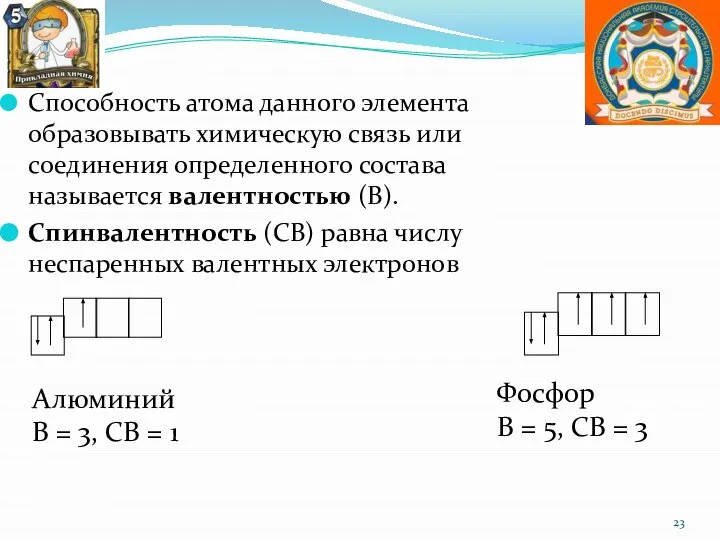
- 23. Способность атома данного элемента образовывать химическую связь или соединения определенного состава называется валентностью (В). Спинвалентность (СВ)
- 24. Энергетические характеристики атомов Энергия ионизации (ионизационный потенциал, I) – это минимальная энергия, необходимая для отрыва одного,
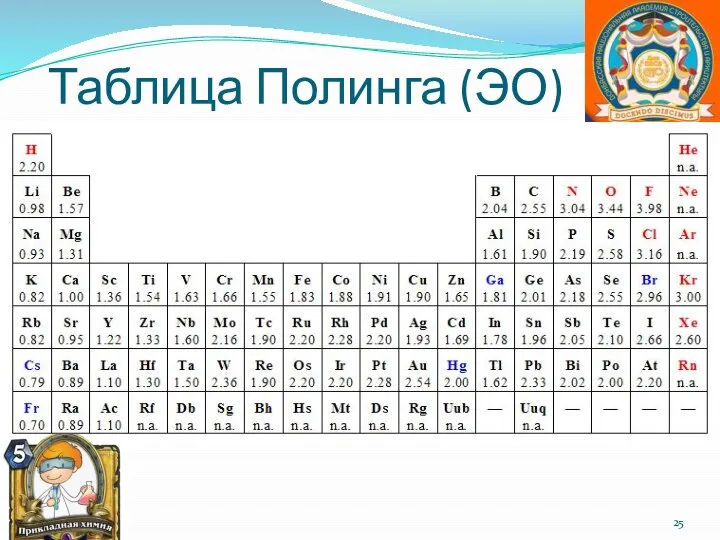
- 25. Таблица Полинга (ЭО)
- 26. План характеристики элемента (1) 1. Название элемента 2. Положение в таблице 3. Заряд ядра 4. Общее
- 27. План характеристики элемента (2) 8. Электронное семейство 9. Валентность, спинвалентность. 10. Поведение в химических реакциях. 11.
- 29. Скачать презентацию















 Кислород
Кислород Промышленное получение аминокислот и их применение в медицине и диетологии
Промышленное получение аминокислот и их применение в медицине и диетологии Тестовая работа по теме: Реакции ионного обмена. Химия. 9 класс
Тестовая работа по теме: Реакции ионного обмена. Химия. 9 класс Деформация полимеров
Деформация полимеров Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Внутренняя среда организма. Система крови. Физико-химические свойства крови
Внутренняя среда организма. Система крови. Физико-химические свойства крови Флотационный способ обогащения
Флотационный способ обогащения Неорганическая и органическая химия
Неорганическая и органическая химия Консультация по химии
Консультация по химии Изомерия
Изомерия Произведение растворимости
Произведение растворимости Химические соединения в живых организмах. Неорганические вещества
Химические соединения в живых организмах. Неорганические вещества Дифференцированный подход в преподавании химии
Дифференцированный подход в преподавании химии Основания
Основания Приходченко ФЕР-2031
Приходченко ФЕР-2031 Процессы подготовки горючих ископаемых к переработке. Лекция № 2
Процессы подготовки горючих ископаемых к переработке. Лекция № 2 Учебник системы учебно-методических комплектов Алгоритм успеха
Учебник системы учебно-методических комплектов Алгоритм успеха Органические соединения
Органические соединения Строение сложного фермента
Строение сложного фермента Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Белки. Структуры белков
Белки. Структуры белков Современные сплавы на основе циркония
Современные сплавы на основе циркония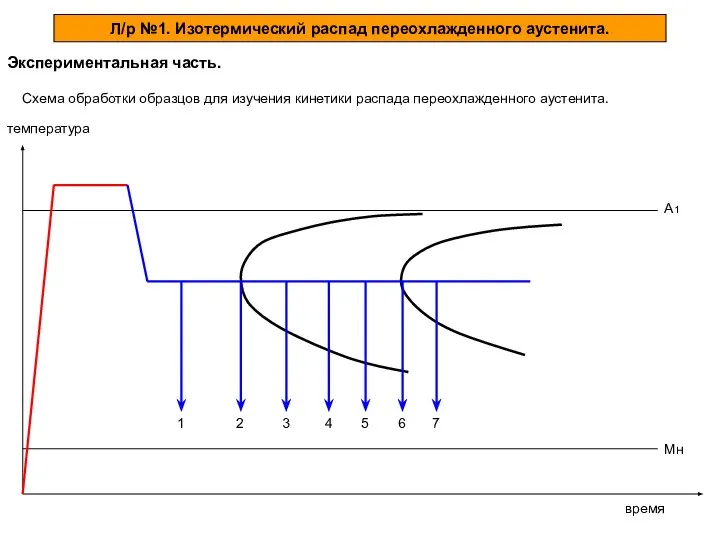 Изотермический распад переохлажденного аустенита. Экспериментальная часть
Изотермический распад переохлажденного аустенита. Экспериментальная часть Алкены
Алкены Цикл фосфора (окончание). Цикл в реках и в море
Цикл фосфора (окончание). Цикл в реках и в море Reshenie_zadach
Reshenie_zadach Салқындатқыш агенттер және оларды салқындату әдістері
Салқындатқыш агенттер және оларды салқындату әдістері Химия в жизни человека
Химия в жизни человека