Содержание
- 2. Оксиды-это сложные вещества, которые состоят из двух элементов, одним из которых является кислород. Общая формула оксидов:
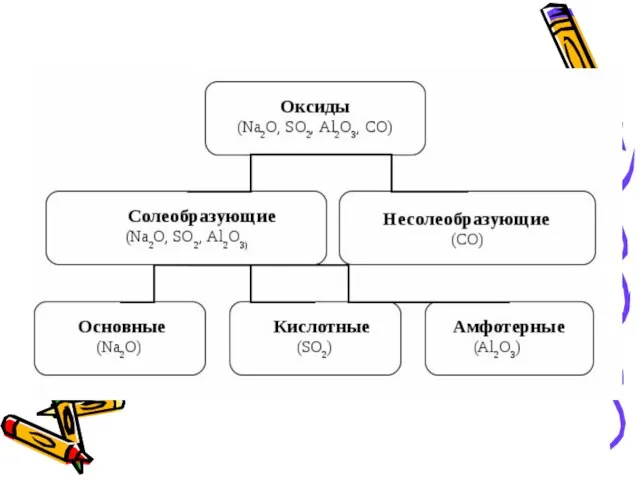
- 5. Несолебразующими называют такие оксиды, которые не взаимодействуют ни с кислотами, ни с щелочами и не образуют
- 6. Солеобразующими называются оксиды, которые взаимодействуют с кислотами или с щелочами с образованием соли и воды.
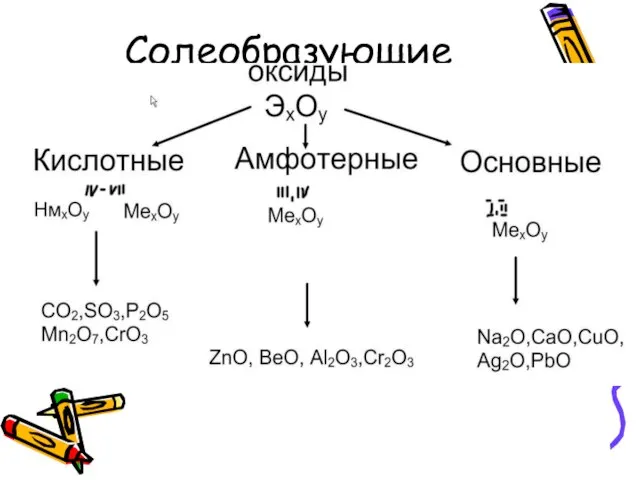
- 7. Солеобразующие оксиды:
- 8. Кислотные оксиды-это такие оксиды, которым соответствуют кислоты (оксиды неМе или металлов с валентностью 3-7) CO2 -
- 9. Нерастворимый в воде кислотный оксид SiO2
- 10. Типичные реакции кислотных оксидов Кислотный оксид + щёлочь→соль + вода (реакция обмена). SO3+2KOH→K2SO4+H2O CO2+Ca(OH)2→CaCO3+H2O Кислотный оксид
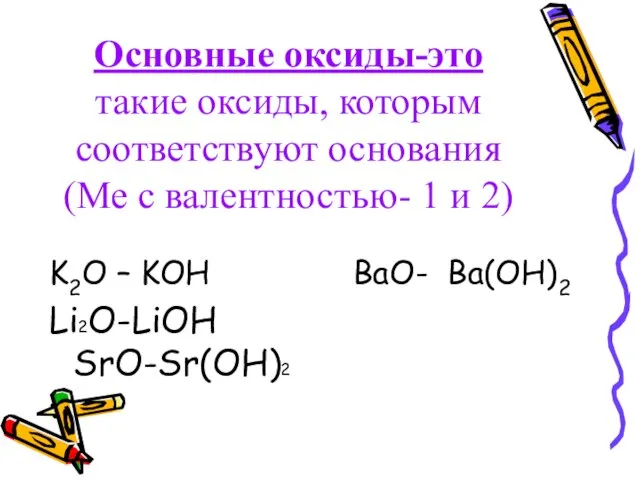
- 11. Основные оксиды-это такие оксиды, которым соответствуют основания (Ме с валентностью- 1 и 2) K2O – KOH
- 12. Типичные реакции основных оксидов Основный оксид + кислота→соль + вода (реакция обмена) CuO + H2SO4→CuSO4 +
- 13. Общие свойства оксидов: Основный оксид + кислотный оксид→ соль (реакция соединения) Li2O + CO2 → Li2CO3
- 14. Задания для закрепления изученной темы: 1).Какие из перечисленных веществ являются оксидами? КОН; SiO2; H2SO4; CaO; NaCl;
- 15. Задание 3:Осуществить следующие превращение: алюминий→оксид алюминия →гидроксид алюминия→бромид алюминия→алюминий. Напишите уравнения реакций.
- 16. Выводы: 1)повторили определение «оксидов», 2)рассмотрели классификацию оксидов по агрегатному состоянию и способности образовывать соли, 3)изучили свойства
- 18. Скачать презентацию












 Химические формулы. Относительная молекулярная масса. 8 класс
Химические формулы. Относительная молекулярная масса. 8 класс Химическая формула. Химия 8 класс
Химическая формула. Химия 8 класс Презентация на тему Палладий
Презентация на тему Палладий  Спирттің сақталуы туралы айтып беріңіз. Көмірқышқылының амидтік туындылары туралы айтып беріңіз
Спирттің сақталуы туралы айтып беріңіз. Көмірқышқылының амидтік туындылары туралы айтып беріңіз Конструкционные и специальные материалы холодильной техники
Конструкционные и специальные материалы холодильной техники Особенные свойства муравьиной кислоты
Особенные свойства муравьиной кислоты Химический диктант как метод формирующего оценивания
Химический диктант как метод формирующего оценивания Характеристика химического элемента по его положению в периодической системе элементов Д. И. Менделеева
Характеристика химического элемента по его положению в периодической системе элементов Д. И. Менделеева Ионные уравнения
Ионные уравнения Дисперсные системы. Лекция №7
Дисперсные системы. Лекция №7 Строение металлов и их сплавов
Строение металлов и их сплавов Алканы
Алканы Обобщение. Неметаллы
Обобщение. Неметаллы Вещество как система. Основы классификации и номенклатуры неорганических веществ
Вещество как система. Основы классификации и номенклатуры неорганических веществ Титан — металл фей
Титан — металл фей Презентация на тему Окислительно – восстановительные реакции
Презентация на тему Окислительно – восстановительные реакции  Обобщение по теме Теория химического строения органических веществ
Обобщение по теме Теория химического строения органических веществ Альдегиды и кетоны. (Лекция 6.2)
Альдегиды и кетоны. (Лекция 6.2) Алкадиены. Каучук. История открытия каучука
Алкадиены. Каучук. История открытия каучука Пищевые добавки
Пищевые добавки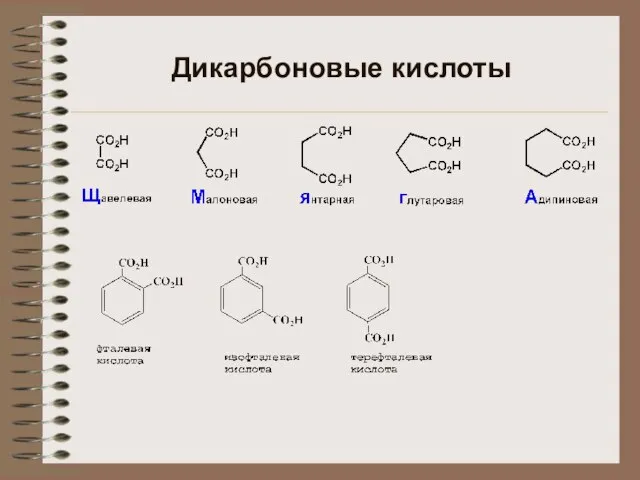 диовые кислоты
диовые кислоты Плазменное состояние вещества
Плазменное состояние вещества Катализ в нефтепереработке
Катализ в нефтепереработке Решение экспериментальных задач по теме Основные классы неорганических соединений. Практическая работа № 4
Решение экспериментальных задач по теме Основные классы неорганических соединений. Практическая работа № 4 Презентация на тему Химические свойства оксидов
Презентация на тему Химические свойства оксидов  Номенклатура алкенов. Теория
Номенклатура алкенов. Теория Вода как растворитель. Растворы. Растворимость. 8 класс
Вода как растворитель. Растворы. Растворимость. 8 класс Валентность. Составление формул по валентности
Валентность. Составление формул по валентности