Содержание
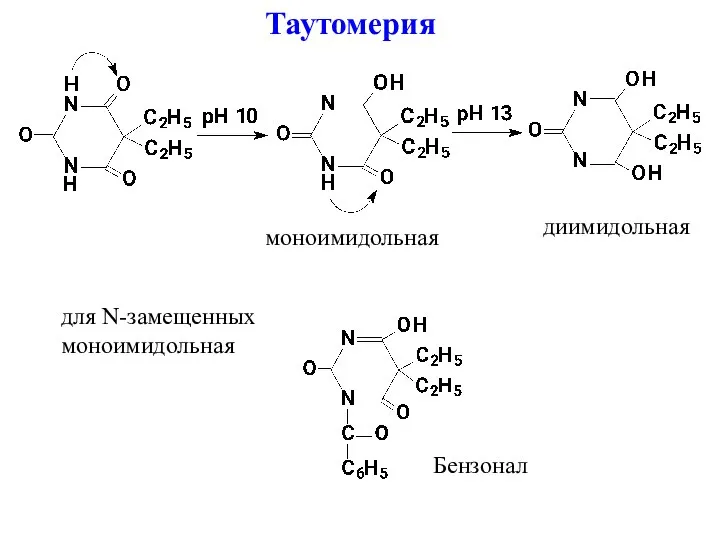
- 2. Различают кислотные и солевые (натриевые) формы барбитуратов. Для всех ЛВ характерна лактим-лактамная таутомерия т.е. все вещества
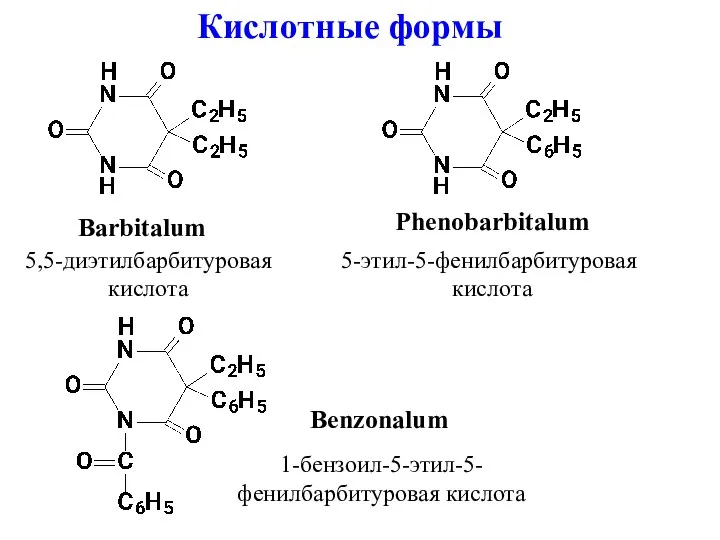
- 3. Barbitalum Phenobarbitalum Benzonalum 5,5-диэтилбарбитуровая кислота 5-этил-5-фенилбарбитуровая кислота 1-бензоил-5-этил-5- фенилбарбитуровая кислота Кислотные формы
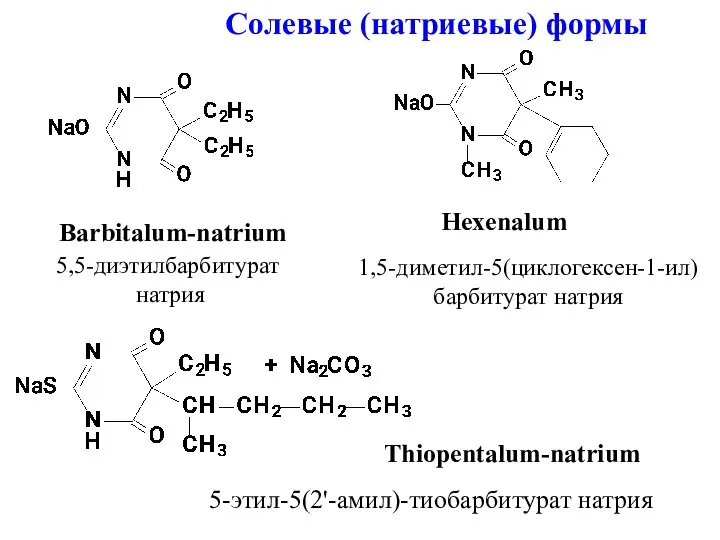
- 4. Солевые (натриевые) формы Barbitalum-natrium Hexenalum Thiopentalum-natrium 5,5-диэтилбарбитурат натрия 1,5-диметил-5(циклогексен-1-ил) барбитурат натрия 5-этил-5(2'-амил)-тиобарбитурат натрия
- 5. Таутомерия моноимидольная диимидольная для N-замещенных моноимидольная Бензонал
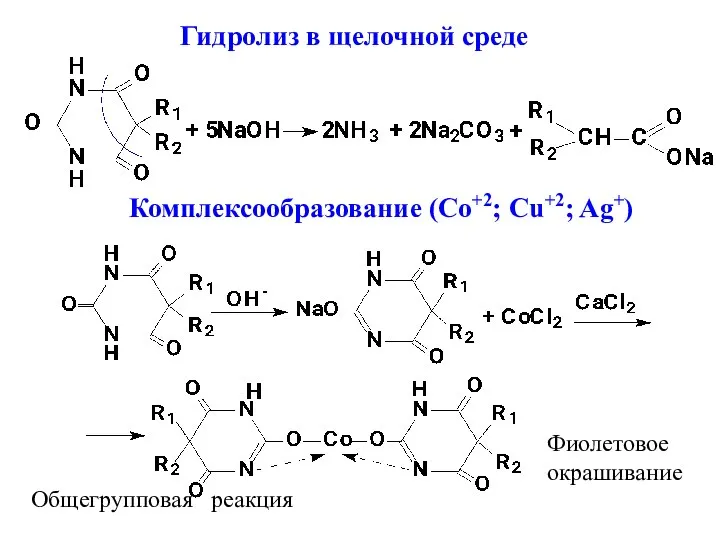
- 6. Реакции подлинности. 1. При гидролизе в щелочной среде образуется аммиак и натриевая соль диалкилуксусной кислоты. При
- 7. Гидролиз в щелочной среде Комплексообразование (Co+2; Cu+2; Ag+) Фиолетовое окрашивание Общегрупповая реакция
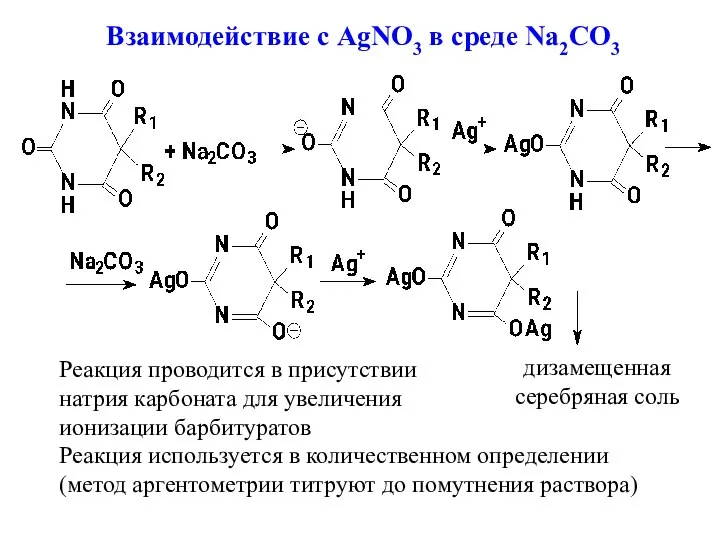
- 8. Взаимодействие с AgNO3 в среде Na2CO3 дизамещенная серебряная соль Реакция проводится в присутствии натрия карбоната для
- 9. Барбитураты могут быть обнаружены с помощью цветных реакций на цикл пиримидина, основанных на окислении. В качестве
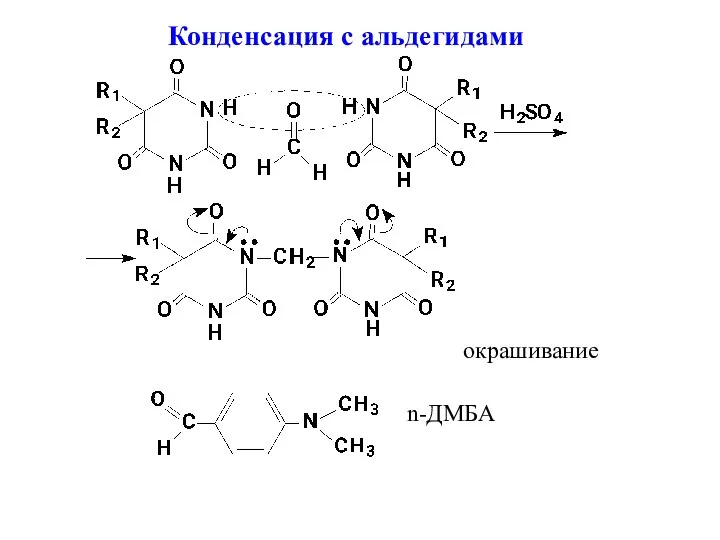
- 10. Конденсация с альдегидами окрашивание n-ДМБА
- 11. Для отличия барбитуратов друг от друга применяются реакции на ФГ: 1. Фенильный радикал (фенобарбитал, бензобарбитал) –
- 12. 4. Присутствие иона натрия – определяют реакцией с пикриновой кислотой и окраске пламени в желтый цвет.
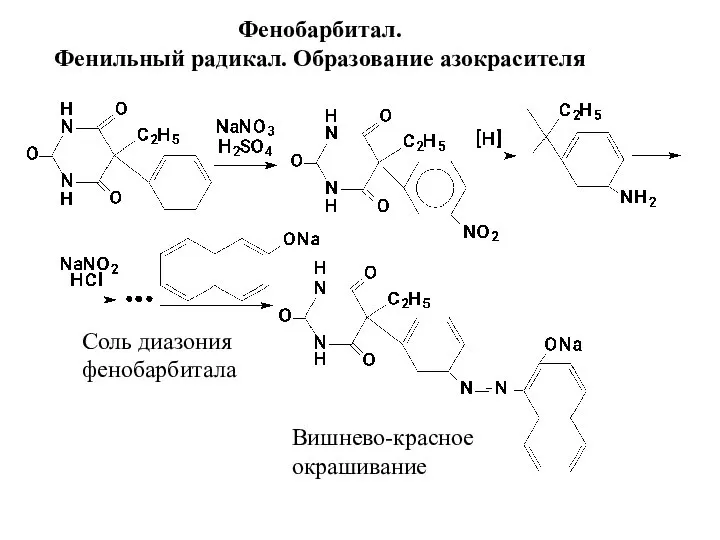
- 13. Фенобарбитал. Фенильный радикал. Образование азокрасителя Соль диазония фенобарбитала Вишнево-красное окрашивание
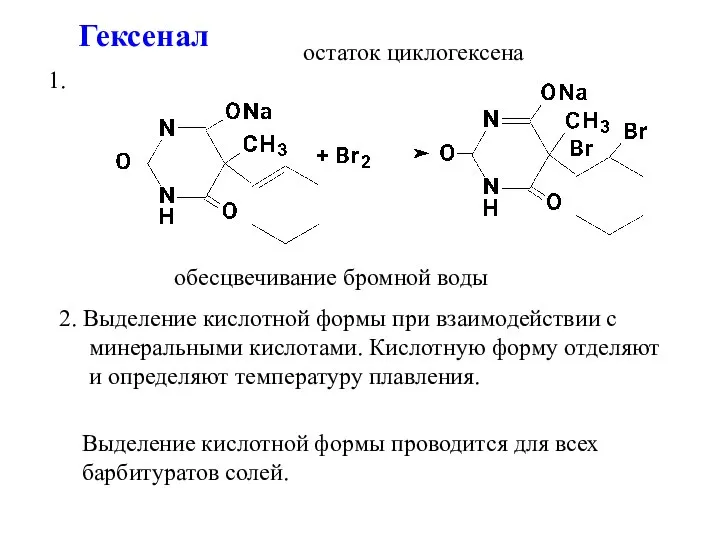
- 14. Гексенал остаток циклогексена обесцвечивание бромной воды 1. 2. Выделение кислотной формы при взаимодействии с минеральными кислотами.
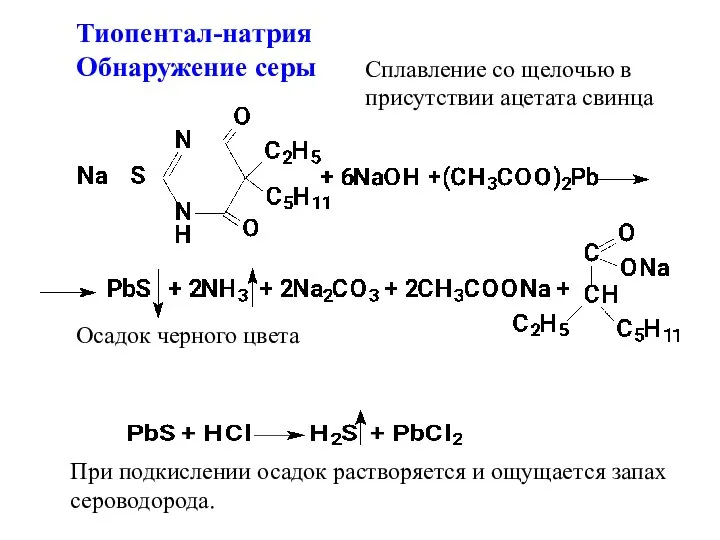
- 15. Тиопентал-натрия Обнаружение серы Сплавление со щелочью в присутствии ацетата свинца Осадок черного цвета При подкислении осадок
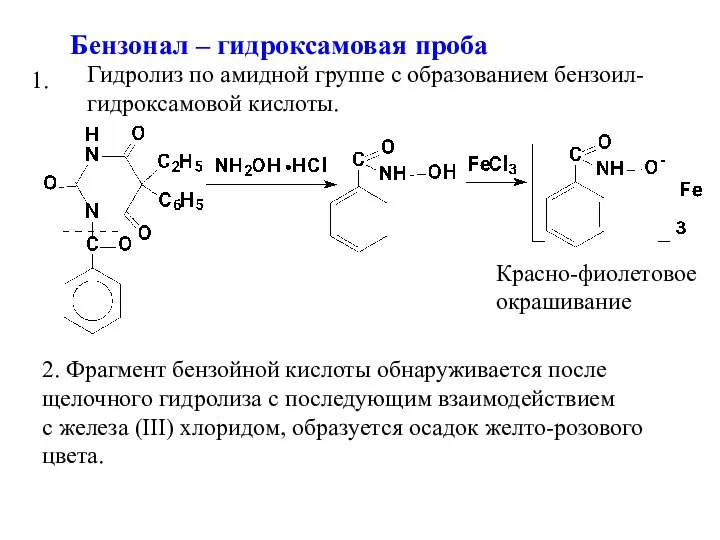
- 16. Бензонал – гидроксамовая проба Красно-фиолетовое окрашивание 1. 2. Фрагмент бензойной кислоты обнаруживается после щелочного гидролиза с
- 17. Физико-химические методы. ИК-спектроскопия в области 4000-400 см-1 ИК-спектры, снятые после прессования в таблетках с калия бромидом,
- 18. Определение примесей. Для субстанций – общие показатели чистоты (хлориды, сульфаты, ионы тяжелых металлов) эталонным способом. Примесь
- 19. Количественное определение. Кислотно-основное титрование в среде протофильного растворителя диметилформамида (ДМФА) или смеси ДМФА и бензола применяют
- 20. серебряной соли (помутнение раствора). Метод гравиметрии применяется для натриевых солей барбитуратов. При этом осаждают кислотную форму
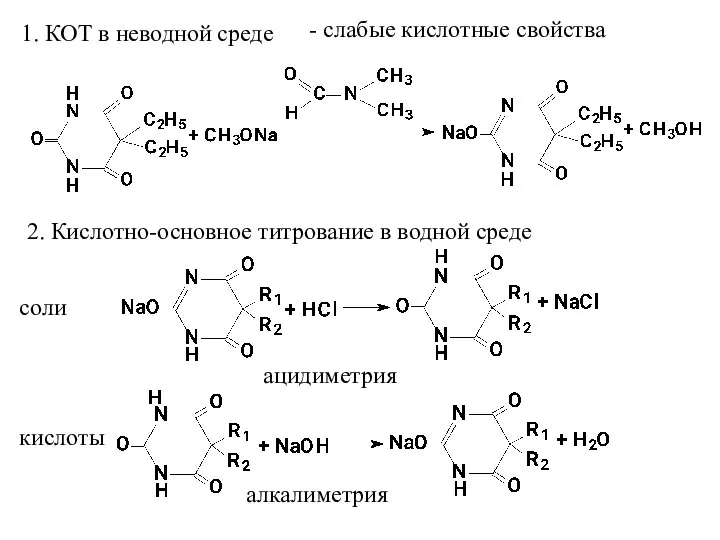
- 21. 1. КОТ в неводной среде 2. Кислотно-основное титрование в водной среде - слабые кислотные свойства соли
- 23. Скачать презентацию









 Химическае препараты
Химическае препараты Разработка системы подготовки лаборанта химического анализа
Разработка системы подготовки лаборанта химического анализа 596550
596550 Алканы и их свойства
Алканы и их свойства Арены. Бензол
Арены. Бензол Состояние электронов в атоме
Состояние электронов в атоме Химическая картина мира
Химическая картина мира Презентация по химии на тему _Закон постоянства со
Презентация по химии на тему _Закон постоянства со Классификация химических реакций. Окислительно-восстановительные реакции
Классификация химических реакций. Окислительно-восстановительные реакции Кислород. Оксиды. Валентность
Кислород. Оксиды. Валентность Методы разделения и очистки веществ
Методы разделения и очистки веществ Основания: определение, классификация, химические свойства
Основания: определение, классификация, химические свойства Презентация на тему Сложные вопросы ЕГЭ по химии
Презентация на тему Сложные вопросы ЕГЭ по химии  Галогениды. Лекция 11
Галогениды. Лекция 11 Исследование n-метилольных производных аллантоина методом тонкослойной хроматографии
Исследование n-метилольных производных аллантоина методом тонкослойной хроматографии Спирты
Спирты Центробежное осаждение
Центробежное осаждение химия конеч 3.0
химия конеч 3.0 Химическое равновесие
Химическое равновесие Образование и получение веществ. Естествознание 6 класс
Образование и получение веществ. Естествознание 6 класс Когда образуется кислая соль?
Когда образуется кислая соль? Соли
Соли Выход продуктов пиролиза бензина
Выход продуктов пиролиза бензина Амины (продолжение). 10 класс
Амины (продолжение). 10 класс Золото. Золотые сплавы
Золото. Золотые сплавы Применение муравьиного спирта
Применение муравьиного спирта Химическа переработка полимерных отходов
Химическа переработка полимерных отходов Пробоотбор и пробоподготовка
Пробоотбор и пробоподготовка