Содержание
- 2. Задание № 1. Определить тип химической связи в молекулах: Na, NaCl, Cl2, HCl
- 3. Степень окисления. Степень окисления - это условный заряд атомов, вычисленный из предположения, что вещество состоит только
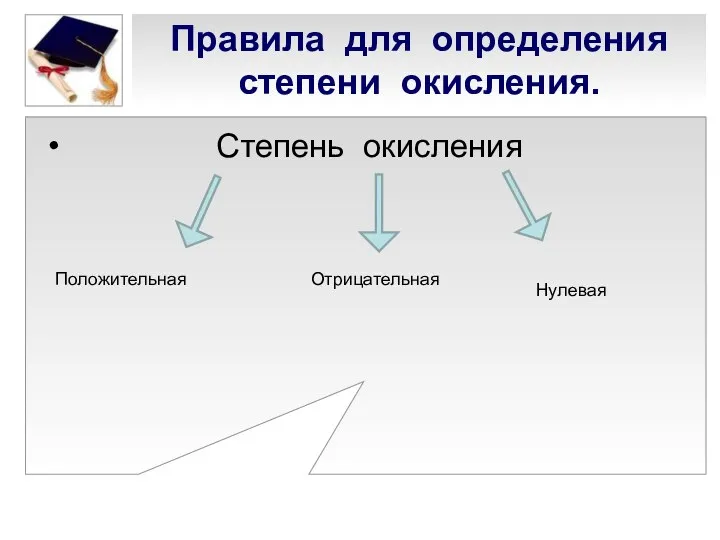
- 4. Степень окисления Правила для определения степени окисления. Положительная Отрицательная Нулевая
- 5. Нулевая степень окисления. Степень окисления простых веществ и свободных атомов всегда равна нулю (0): 0 О2
- 6. Отрицательная степень окисления Степень окисления фтора (F) всегда равна -1
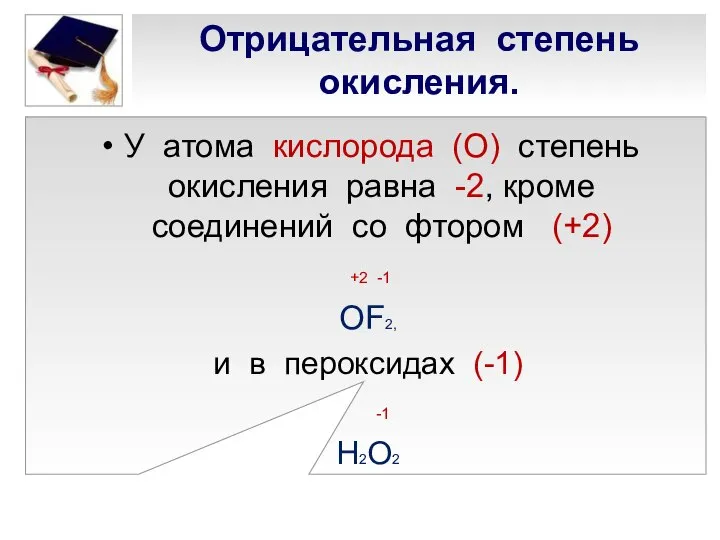
- 7. Отрицательная степень окисления. У атома кислорода (О) степень окисления равна -2, кроме соединений со фтором (+2)
- 8. Положительная степень окисления. У металлов степень окисления всегда положительна и равна номеру группы (для металлов главных
- 9. Положительная степень окисления. У атома водорода степень окисления равна +1 +1 -2 Н2О, Кроме соединений с
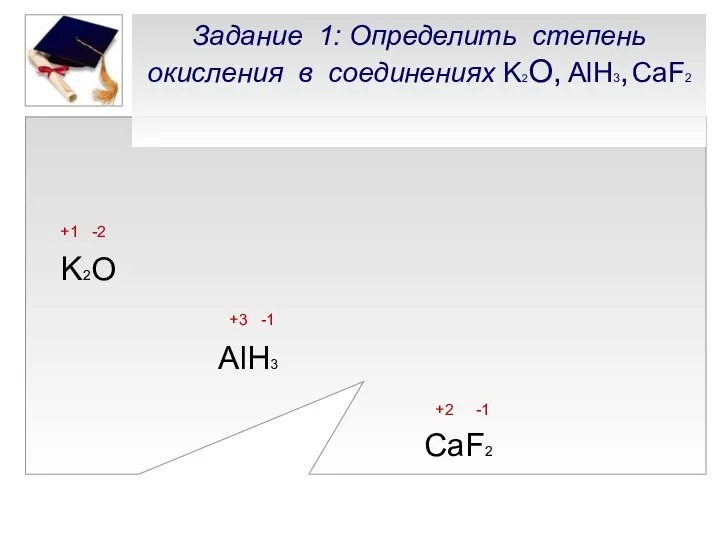
- 10. Задание 1: Определить степень окисления в соединениях K2О, AlH3, CaF2 +1 -2 K2O +3 -1 AlH3
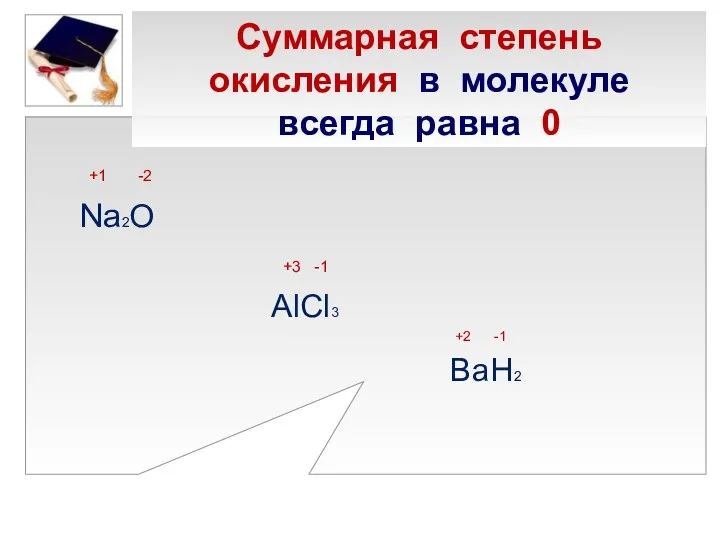
- 11. Суммарная степень окисления в молекуле всегда равна 0 +1 -2 Na2O +3 -1 AlCl3 +2 -1
- 12. Бинарные соединения. Бинарные соединения – это соединения, состоящие из двух химических элементов.
- 13. Бинарные соединения. На первом месте всегда записывается элемент с положительной степенью окисления, а на втором -
- 14. Названия бинарных соединений. На первом месте в названии бинарного соединения записывается латинское название элемента с отрицательной
- 15. Названия бинарных соединений. Названия элементов с отрицательной степенью окисления: Cl - хлорид О - оксид Н
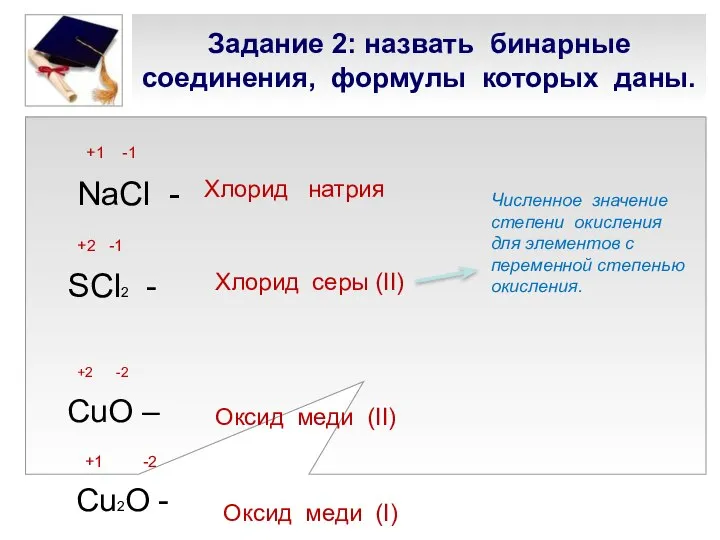
- 16. Задание 2: назвать бинарные соединения, формулы которых даны. +1 -1 NaCl - +2 -1 SCl2 -
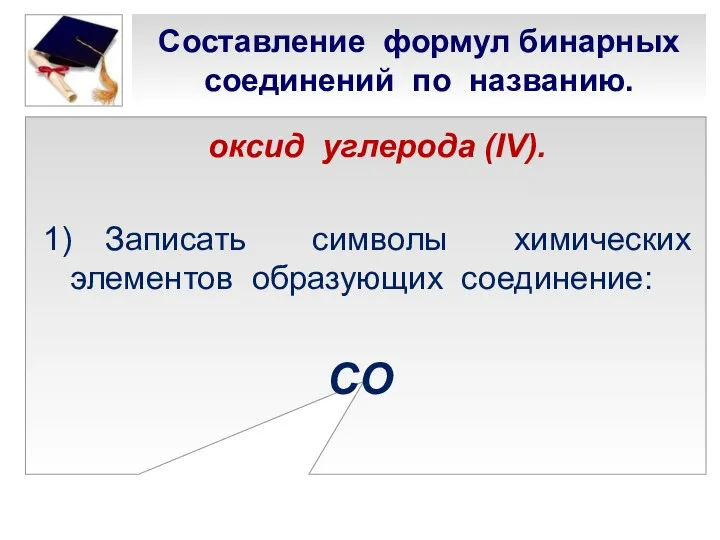
- 17. Составление формул бинарных соединений по названию. оксид углерода (IV). 1) Записать символы химических элементов образующих соединение:
- 18. Составление формул бинарных соединений по названию. 2) Над атомами химических элементов в соединении проставить их степени
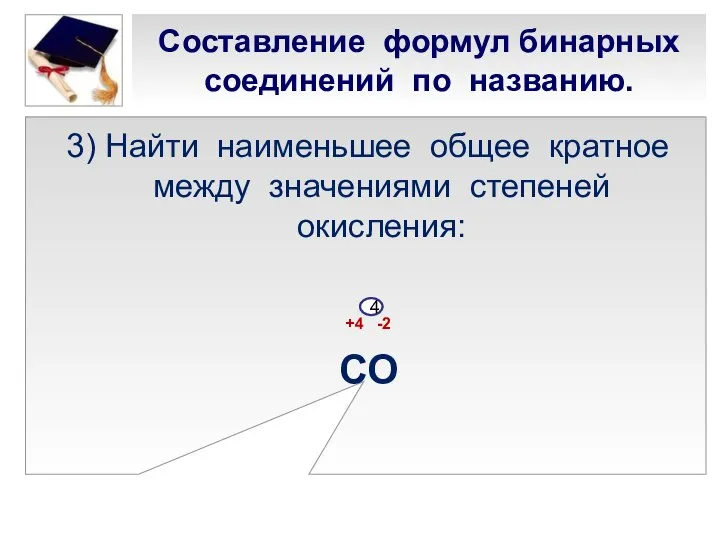
- 19. Составление формул бинарных соединений по названию. 3) Найти наименьшее общее кратное между значениями степеней окисления: +4
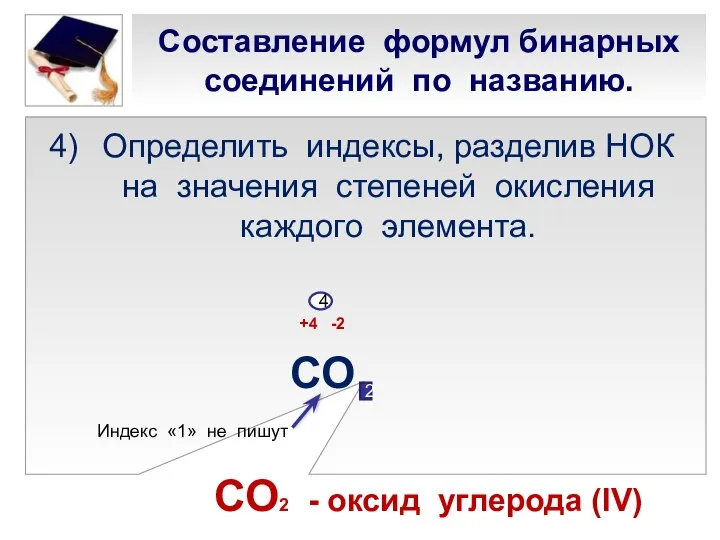
- 20. Составление формул бинарных соединений по названию. Определить индексы, разделив НОК на значения степеней окисления каждого элемента.
- 21. Задание 3: Составить формулы веществ по названиям. Сульфид лития - Оксид серы (IV) - Оксид азота
- 22. Домашнее задание: § 17 Назвать вещества: NO, N2O, N2O3, PCl3, PCl5, CuCl2. Составить формулы веществ по
- 24. Скачать презентацию













 Природные источники углеводородов
Природные источники углеводородов Алкины. Понятие об алкинах
Алкины. Понятие об алкинах Скорость протекания химических реакций
Скорость протекания химических реакций Химия. Решение задач
Химия. Решение задач Карбонат калия K2CO3
Карбонат калия K2CO3 Пример выполнения проверочной работы по теме углеводороды
Пример выполнения проверочной работы по теме углеводороды Количество вещества. Моль
Количество вещества. Моль Тренажёр: знаки химических элементов
Тренажёр: знаки химических элементов Гликоген. Синтез гликогена
Гликоген. Синтез гликогена Применение алканов
Применение алканов Химия – наука о веществах. Вычисления по химическим формулам. Тема 1
Химия – наука о веществах. Вычисления по химическим формулам. Тема 1 Простые и сложные вещества
Простые и сложные вещества Химические свойства кислот
Химические свойства кислот Тест по теме Основные классы неорганических соединений
Тест по теме Основные классы неорганических соединений Классы неорганических соединений
Классы неорганических соединений Презентация на тему Химические свойства оксидов
Презентация на тему Химические свойства оксидов  Презентация на тему Амины
Презентация на тему Амины  НХ 3 Термохимия
НХ 3 Термохимия Дисперсные системы
Дисперсные системы Презентация на тему Сера
Презентация на тему Сера  Катаболизм пуриновых нуклеотидов
Катаболизм пуриновых нуклеотидов Готовимся к ЕГЭ по органической химии Ароматические углеводороды
Готовимся к ЕГЭ по органической химии Ароматические углеводороды Электрические явления на поверхности раздела фаз. Лекция 8
Электрические явления на поверхности раздела фаз. Лекция 8 Щелочные металлы
Щелочные металлы Общая характеристика неметаллов подгруппы кислород
Общая характеристика неметаллов подгруппы кислород Презентация на тему Вода – растворитель
Презентация на тему Вода – растворитель  Химия функциональных материалов. Адсорбция
Химия функциональных материалов. Адсорбция Основные виды сырья для промышленности органического и нефтехимического синтеза
Основные виды сырья для промышленности органического и нефтехимического синтеза