Слайд 2Окислительно – восстановительные реакции-
это реакции, протекающие с изменением степеней окисления атомов химических

элементов или ионов, входящих в состав реагирующих веществ
Слайд 3H2SO4 (разб.), окислитель Н+
H2 - продукт восстановления металлом, стоящим в

электрохимическом ряду напряжения до водорода
Zn + H2SO4 (разб.) → ZnSO4 + H2
Zn0 – 2 ẽ → Zn+2 1 восстановитель, процесс окисления
2 H+ + 2 ẽ → H2 0 1 окислитель, процесс восстановления
Слайд 4Взаимодействие цинка с концентрированной серной кислотой
4Zn + 5H2SO4 (конц.) →
4ZnSO4

+ H2S + 4H2O
Zn0 – 2 ẽ → Zn+2 4 восстановитель, процесс окисления
S+6 + 8 ẽ → S -2 1 окислитель, процесс восстановления
Слайд 5H2SO4 (конц.), окислитель S+6
активный металл
Li – Zn
Соль +

H2S-2 + H2O
металл средней активности
Cd – Pb
Соль + S0 + H2O
неактивный металл
+6 (после H2) и Fe (при нагревании)
H2SO4 Соль + S+4О2 + H2O
(КОНЦ.) не реагирует
Au, Pt
при обычной температуре
пассивируются
Al, Cr, Fe
Слайд 6HNO3, окислитель N+5
не реагирует
Au, Pt
+5 независимо от активности
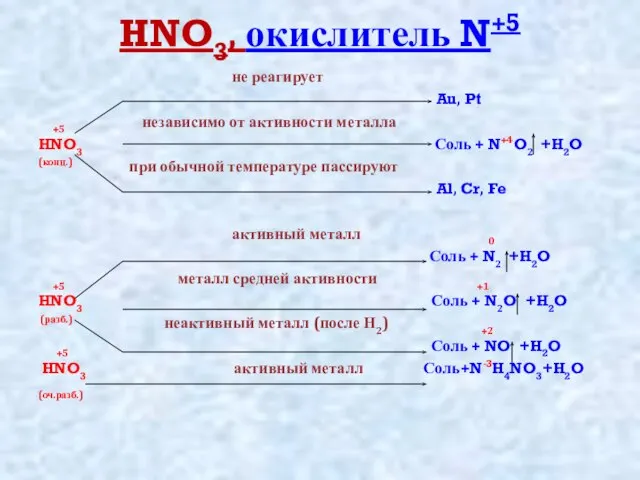
металла
HNO3 Соль + N+4O2 +H2O
(конц.) при обычной температуре пассируют
Al, Cr, Fe
активный металл 0
Соль + N2 +H2O
+5 металл средней активности +1
HNO3 Соль + N2O +H2O
(разб.) неактивный металл (после Н2) +2
+5 Соль + NO +H2O
HNO3 активный металл Соль+N-3H4NO3+H2O
(оч.разб.)
Слайд 7Продукт восстановления MnO4- в различных средах
Н+
Mn+2, бесцветный
раствор
H2O
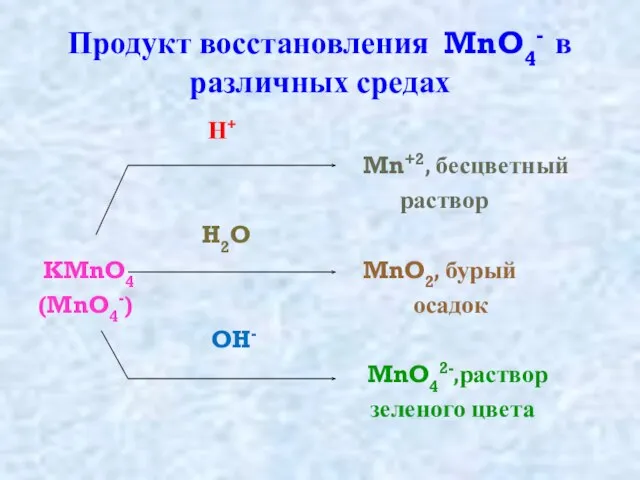
KMnO4 MnO2, бурый
(MnO4-) осадок
OH-
MnO42-,раствор
зеленого цвета
Слайд 8
Пятна от раствора перманганата калия быстро выводятся раствором пероксида водорода,

подкисленным уксусной кислотой:
2KMnO4 + 9H2O2 + 6CH3COOH =
2Mn(CH3COO)2 +2CH3COOK + 7O2 + 12H2O
Старые пятна перманганата калия содержат оксид марганца (IV), поэтому будет протекать еще одна реакция:
MnO2 + 3H2O2 + 2CH3COOH =
Mn(CH3COO)2 + 2O2 + 4H2O
Слайд 9Домашнее задание:
Используя схемы, данные на уроке, закончите
уравнения реакций и

расставьте в них коэффициенты:
• AI + H2SO4 (конц.) →
• Ag + HNO3 (конц.) →
• KBr + KMnO4 + H2SO4 →
Br2 + …… + K2SO4 + H2O








 Физическая и коллоидная химия
Физическая и коллоидная химия Сплавы, растворы, смеси
Сплавы, растворы, смеси Изготовление слайма в домашних условиях
Изготовление слайма в домашних условиях Кислородсодержащие органические вещества. Тест
Кислородсодержащие органические вещества. Тест Очистка поваренной соли методом кристаллизации в домашних условиях
Очистка поваренной соли методом кристаллизации в домашних условиях Вода - это жизнь
Вода - это жизнь Строение атома, 11 класс
Строение атома, 11 класс Ниобий. Химические свойства
Ниобий. Химические свойства Работа по химии и информатике Селезневой Алены
Работа по химии и информатике Селезневой Алены Primenenie_kauchukov
Primenenie_kauchukov Electrochemical properties of arylsilanes
Electrochemical properties of arylsilanes Презентация на тему Гигиенические аспекты загрязнения пищевых продуктов чужеродными веществами
Презентация на тему Гигиенические аспекты загрязнения пищевых продуктов чужеродными веществами  Химия неорганическая и органическая
Химия неорганическая и органическая Характеристика химического элемента на основании его положения в Периодической системе Д. И. Менделеева
Характеристика химического элемента на основании его положения в Периодической системе Д. И. Менделеева ОВР химияПрезентация
ОВР химияПрезентация Теоретические основы аналитичесой химии. Общие понятия
Теоретические основы аналитичесой химии. Общие понятия Вещество. Свойства веществ
Вещество. Свойства веществ Классы неорганических веществ. Оксиды
Классы неорганических веществ. Оксиды Оксиды
Оксиды Презентация на тему Химия в сельском хозяйстве
Презентация на тему Химия в сельском хозяйстве  Презентация на тему Расчеты по химическим уравнениям
Презентация на тему Расчеты по химическим уравнениям  Нуклеин қышқылдары
Нуклеин қышқылдары (+)-Plumisclerin A. Плюмисклин А
(+)-Plumisclerin A. Плюмисклин А ЛБ 1 ОВР (1)
ЛБ 1 ОВР (1) Многогранность- моё второе имя. Задача
Многогранность- моё второе имя. Задача Новогодний Пробник №190415
Новогодний Пробник №190415 Получение алканов
Получение алканов Нефть и основные продукты её переработки
Нефть и основные продукты её переработки