Содержание
- 2. Расскажу сегодня, что ли, О зловредной роли моли. Моль съедает шерсть и мех – Просто паника
- 3. Моль Моль – это такое количество вещества, в котором содержится 6*10 23 молекул (или других структурных
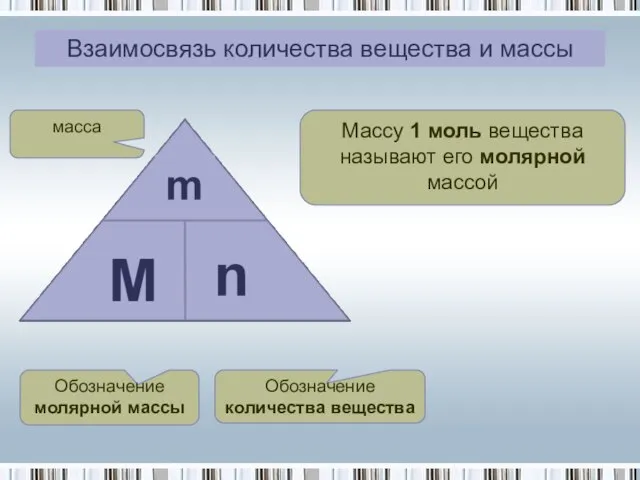
- 4. Взаимосвязь количества вещества и массы Массу 1 моль вещества называют его молярной массой Обозначение молярной массы
- 5. Единицы измерения [ М] – г/моль, [ m] – г, кг/кмоль, кг, мг/ммоль. мг. [ n]
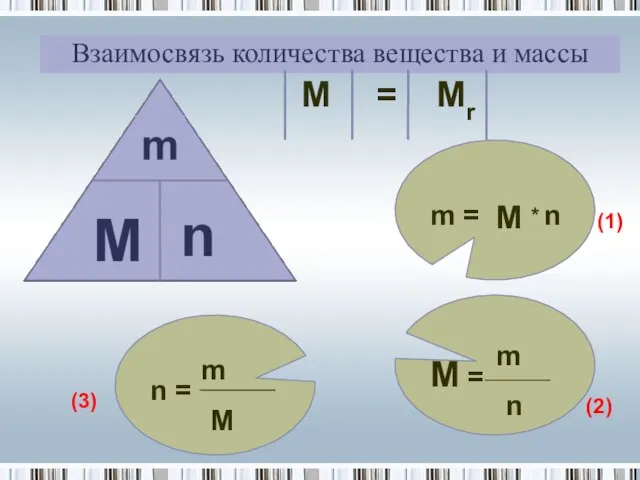
- 6. Взаимосвязь количества вещества и массы m = M n (1) M = m n (2) n
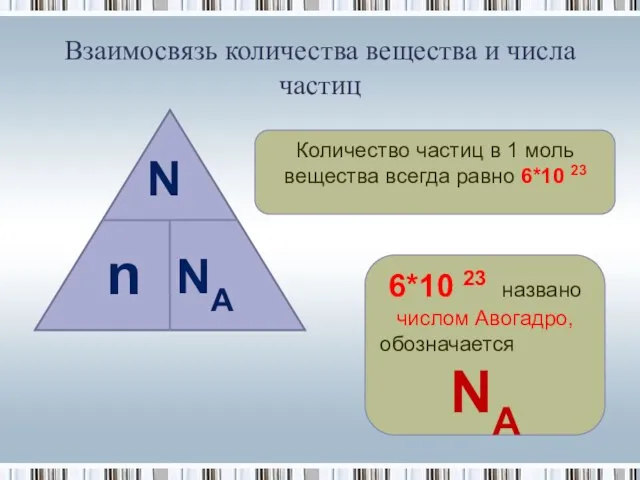
- 7. Взаимосвязь количества вещества и числа частиц Количество частиц в 1 моль вещества всегда равно 6*10 23
- 8. Куча песка, засыпавшая большой завод, содержит песчинок в 22400 раз меньше, чем число частиц в 1
- 9. Ниагарский водопад (США)
- 10. Число Авогадро - NA Некоторое представление о величине числа Авогадро даёт следующий пример. Количество воды, которое
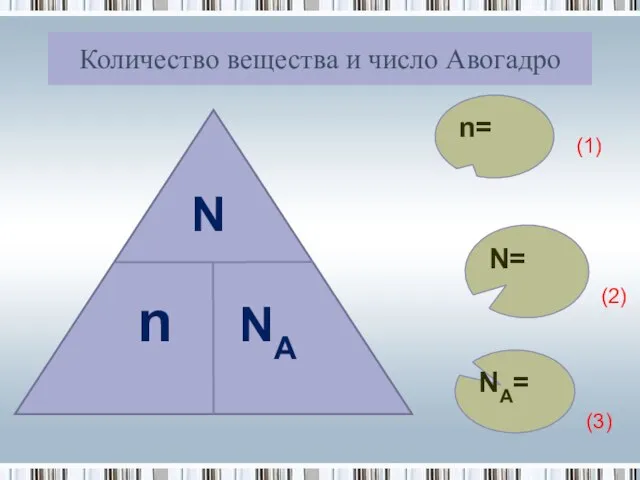
- 11. Количество вещества и число Авогадро n= N= NA= (1) (2) (3)
- 12. тема урока Относительная атомная и молекулярная массы
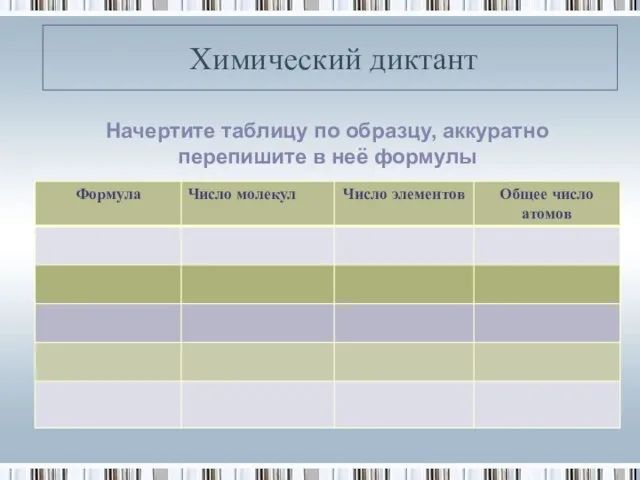
- 13. Химический диктант Начертите таблицу по образцу, аккуратно перепишите в неё формулы
- 14. Задания
- 15. Относительная атомная масса Атомы элементов характеризуются определённой (только им присущей) массой. Например, масса атома Н равна
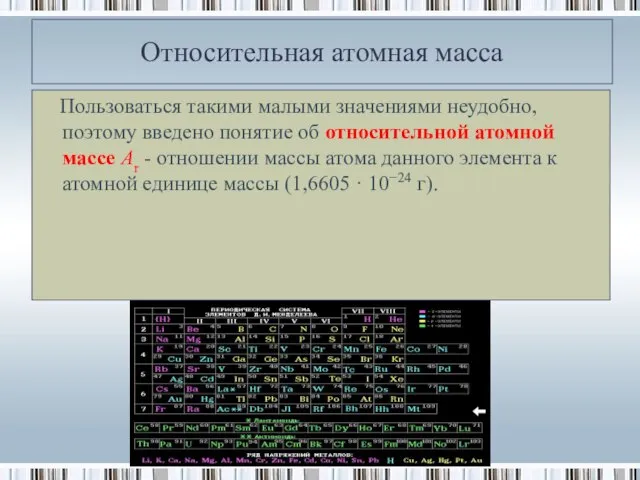
- 16. Относительная атомная масса Пользоваться такими малыми значениями неудобно, поэтому введено понятие об относительной атомной массе Аr
- 17. Относительная молекулярная масса - Мr Значения относительной молекулярной массы рассчитываются из значений относительной атомной массы с
- 18. Относительная молекулярная масса - Мr Установлено, что 12 г углерода (в виде графита или алмаза) содержат
- 19. Массовая доля элемента в сложном веществе По известной химической формуле сложного вещества определяют массовые доли элементов,
- 20. Массовая доля элемента в сложном веществе Массовая доля элемента - это доля от единицы или доля
- 21. Домашнее задание § 16, № 2,3
- 23. Скачать презентацию


![Единицы измерения [ М] – г/моль, [ m] – г, кг/кмоль, кг,](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/849541/slide-4.jpg)











 Исследовательский проект по химии на тему: Жесткость воды и способы ее устранения
Исследовательский проект по химии на тему: Жесткость воды и способы ее устранения Кислородсодержащие соединения азота. Оксиды азота
Кислородсодержащие соединения азота. Оксиды азота Биохимия. Основные классы соединений. Аминокислоты и Белки
Биохимия. Основные классы соединений. Аминокислоты и Белки Аймақтық мета морфизм тауж ыныстары
Аймақтық мета морфизм тауж ыныстары Степени окисления и формулы веществ
Степени окисления и формулы веществ Соли в свете теории электролитической диссоциации
Соли в свете теории электролитической диссоциации Силикатная промышленность
Силикатная промышленность Нанохімія та основи нанотехнологій
Нанохімія та основи нанотехнологій Презентация Повторение к СОЧ-10 кл (1)
Презентация Повторение к СОЧ-10 кл (1) Подгруппа углерода
Подгруппа углерода Неорганическая химия, часть 1
Неорганическая химия, часть 1 Анилин. Строение и свойства анилина
Анилин. Строение и свойства анилина Искусственные и синтетические полимеры
Искусственные и синтетические полимеры Признаки реакции
Признаки реакции ЛКМ на основе кремнийорганических соединений
ЛКМ на основе кремнийорганических соединений Химические методы количественного анализа веществ
Химические методы количественного анализа веществ Химический элемент Франций (Fr)
Химический элемент Франций (Fr) Органическая химия. Йенс Якоб Берцелиус (1779 - 1848)
Органическая химия. Йенс Якоб Берцелиус (1779 - 1848) Коррозия металлов
Коррозия металлов Приходченко ФЕР-2031
Приходченко ФЕР-2031 Кислород
Кислород Презентация на тему Великие химики
Презентация на тему Великие химики  Презентация на тему Подгруппа углерода и азота
Презентация на тему Подгруппа углерода и азота  Алюминий. Положение алюминия в периодической системе и строение его атома
Алюминий. Положение алюминия в периодической системе и строение его атома Арены. Бензол
Арены. Бензол Количество вещества. Молярная масса. Молярный объем
Количество вещества. Молярная масса. Молярный объем Химические средства защиты растений
Химические средства защиты растений Классификация неорганических веществ
Классификация неорганических веществ