Содержание
- 2. Двойственная природа электрона Электрон имеет массу и заряд, как частица. Электрон проявляет волновые свойства – способен
- 3. Электрон в атоме может находиться в любой точке пространства вокруг ядра, однако вероятность его пребывания в
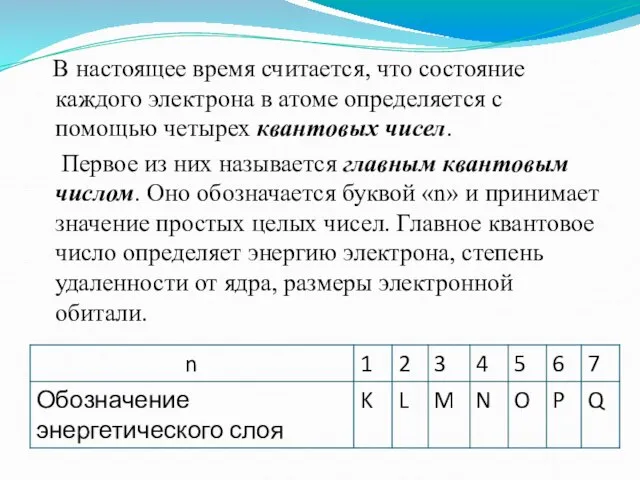
- 4. В настоящее время считается, что состояние каждого электрона в атоме определяется с помощью четырех квантовых чисел.
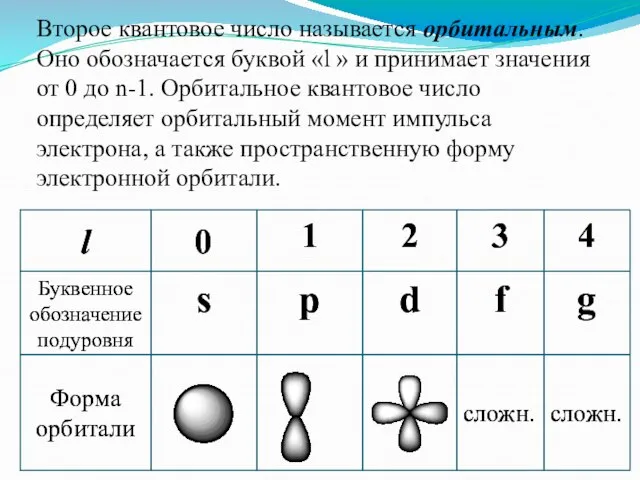
- 5. Второе квантовое число называется орбитальным. Оно обозначается буквой «l » и принимает значения от 0 до
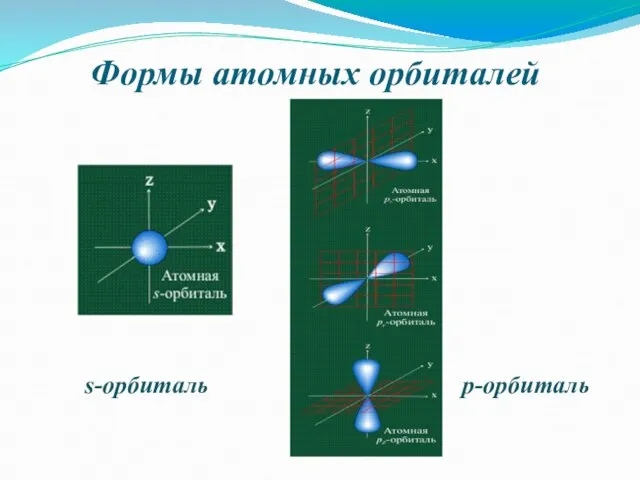
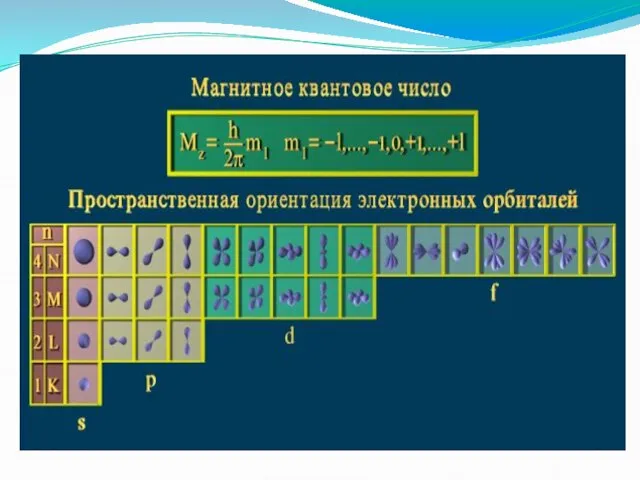
- 6. Формы атомных орбиталей s-орбиталь p-орбиталь
- 7. Формы атомных орбиталей d-АО
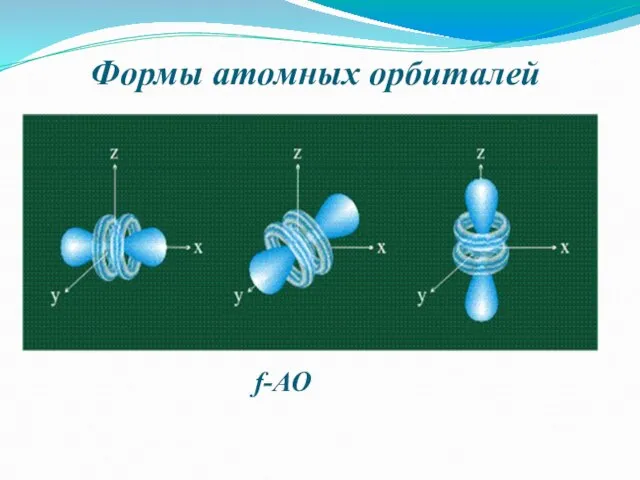
- 8. Формы атомных орбиталей f-АО
- 9. Число подуровней, на которые расщепляется энергетический уровень равно номеру уровня. Энергетический подуровень – это совокупность электронных
- 10. Магнитное квантовое число ml определяет значения проекции орбитального момента на одной из осей, а также пространственную
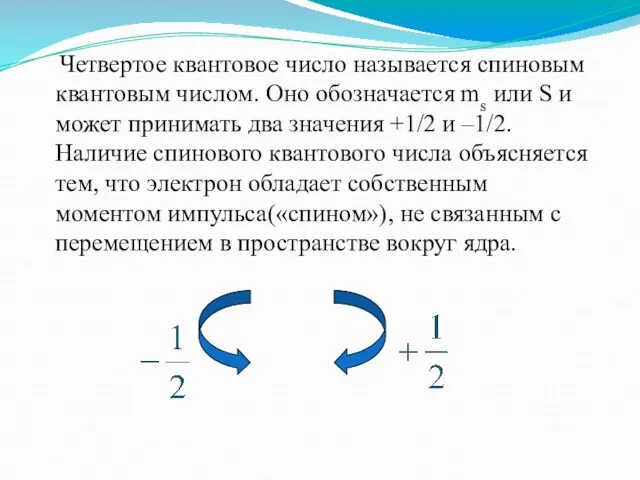
- 12. Четвертое квантовое число называется спиновым квантовым числом. Оно обозначается ms или S и может принимать два
- 13. Общая характеристика состояния электрона в многоэлектронном атоме определяется принципом Паули: в атоме не может быть двух
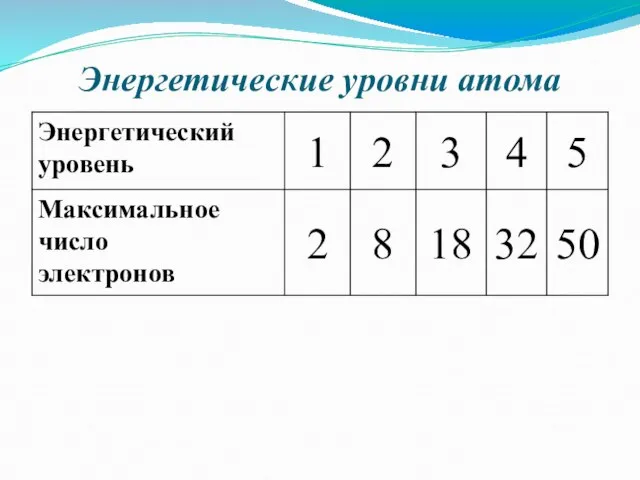
- 14. Энергетические уровни атома
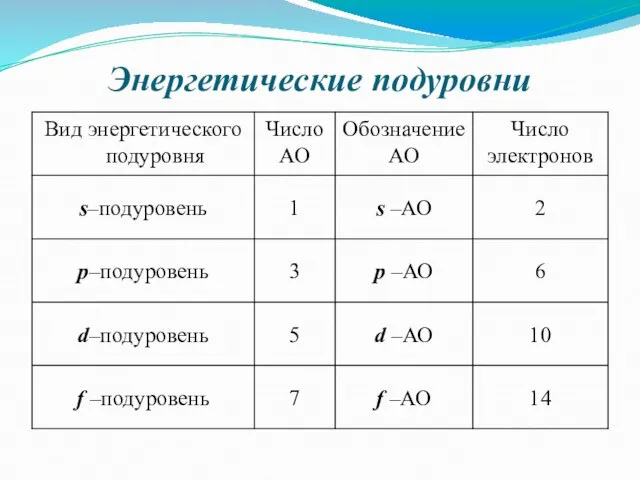
- 15. Энергетические подуровни
- 16. Ссылки на интернет-источники 1. Статья «Квантовые числа электрона»: http://www.chemistry.ru/course/content/chapter2/section/paragraph2/theory.html 2. Статья «Квантовые числа электрона»: http://www.himhelp.ru/section23/section2/section9/ 3.
- 18. Скачать презентацию







 Вычислительные методы в химии. Что такое вычислительная (компьютерная) химия. Лекция 1
Вычислительные методы в химии. Что такое вычислительная (компьютерная) химия. Лекция 1 Заполни электронные уровни элементов
Заполни электронные уровни элементов Виды изомерии у моносахаридов
Виды изомерии у моносахаридов Электроосмос. Практическое применение электроосмоса
Электроосмос. Практическое применение электроосмоса Простые вещества – неметаллы. Получение и химические свойства неметаллов
Простые вещества – неметаллы. Получение и химические свойства неметаллов Звездный час. Конкурс химиков
Звездный час. Конкурс химиков Ионная химическая связь
Ионная химическая связь Свойства черных и цветных металлов
Свойства черных и цветных металлов Презентация на тему Законы электролиза
Презентация на тему Законы электролиза  Химические реакции разложения и соединения
Химические реакции разложения и соединения Перициклические реакции
Перициклические реакции Новые грани парфюмерии. Задача 5
Новые грани парфюмерии. Задача 5 Свойства кремниевой кислоты и области применения силикатов
Свойства кремниевой кислоты и области применения силикатов Спирты и их производные
Спирты и их производные Углеводы. Тема 9
Углеводы. Тема 9 Соли
Соли Значение коллодиной химии в производстве
Значение коллодиной химии в производстве Производство стекла
Производство стекла Презентация на тему Барометр анероид
Презентация на тему Барометр анероид  Способы разделения нефти. Ректификация
Способы разделения нефти. Ректификация Некоторые понятия общей химии в виртуальных моделях
Некоторые понятия общей химии в виртуальных моделях Презентация на тему Обратимость химических реакций. Химическое равновесие
Презентация на тему Обратимость химических реакций. Химическое равновесие  Химическая термодинамика. Экзаменационные вопросы
Химическая термодинамика. Экзаменационные вопросы Строение атома
Строение атома Углеводороды (УВ)
Углеводороды (УВ) Удивительные кристаллы Выполнена учеником 8 а класса Савиным Анатолием Учитель: Звёздочкина С.А.
Удивительные кристаллы Выполнена учеником 8 а класса Савиным Анатолием Учитель: Звёздочкина С.А. 42. Ионные уравнения
42. Ионные уравнения Особенности решения практикоориентированного задания №26 ГИА-11
Особенности решения практикоориентированного задания №26 ГИА-11