Содержание
- 2. Содержание Строение алканов Изомерия и номенклатура алканов Получение Физические свойства Химические свойства Нахождение в природе Применение
- 3. Строение алканов Алканы – углеводороды, молекулы которых состоят из атомов углерода и водорода, связанных друг с
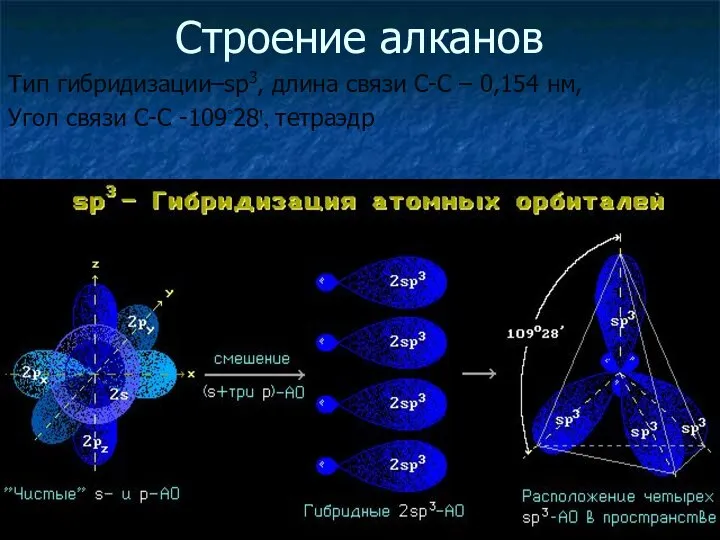
- 4. Строение алканов Тип гибридизации–sp3, длина связи С-С – 0,154 нм, Угол связи С-С -109◦28ꞌ, тетраэдр
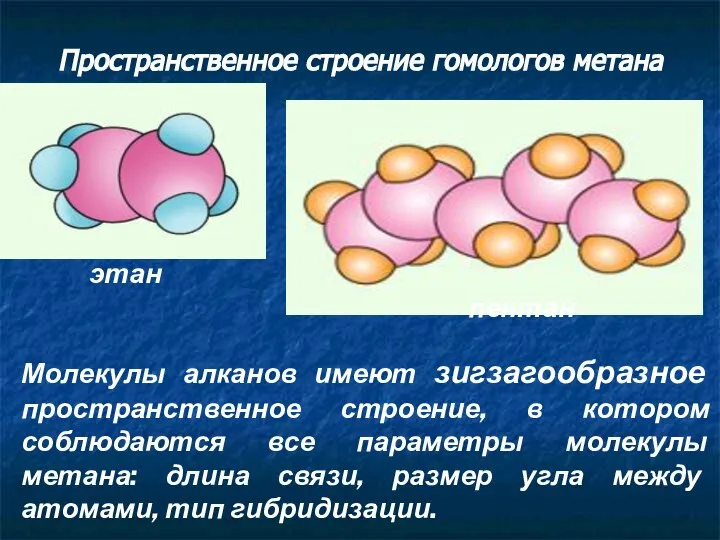
- 5. Пространственное строение гомологов метана этан пентан Молекулы алканов имеют зигзагообразное пространственное строение, в котором соблюдаются все
- 6. H3C – CH2 – CH2 – CH2 – CH3 пентан первичный вторичный H3C – CH2 –
- 7. Изомерия 1. Структурная изомерия. Для алканов характерна изомерия углеродного скелета. CH3 – CH – CH3 CH3-CH2-CH2-CH3
- 8. Номенклатура алканов За основу принимают название углеводорода, которому соответствует в рассмотренном соединении самая длинная цепь. Эта
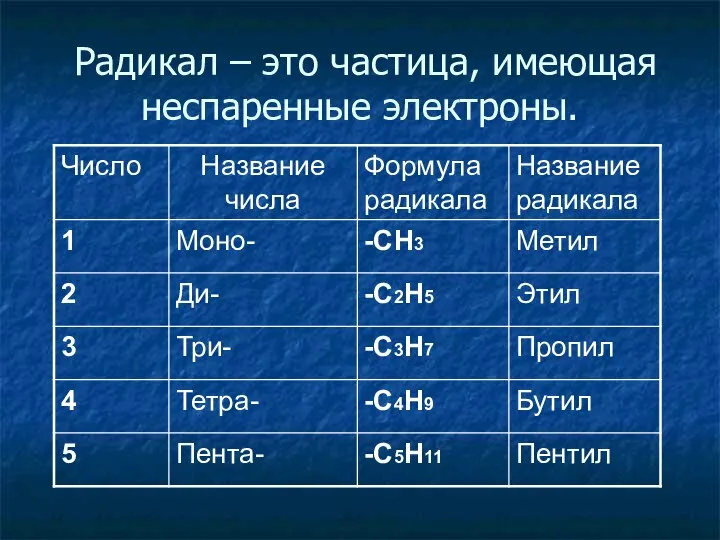
- 9. Радикал – это частица, имеющая неспаренные электроны.
- 10. Номенклатура алканов Алгоритм. 1. Выбор главной цепи: CH3 – CH - CH2 - CH3 │ CH3
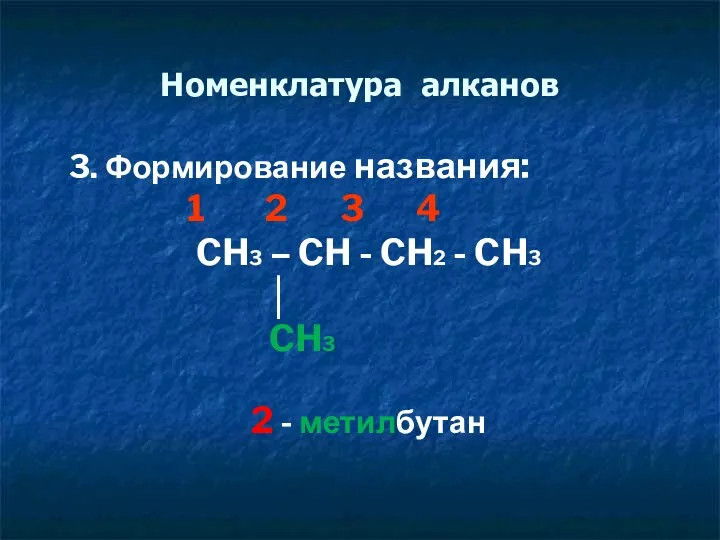
- 11. Номенклатура алканов 3. Формирование названия: 1 2 3 4 CH3 – CH - CH2 - CH3
- 12. ЗАДАНИЕ. Дайте названия следующим углеводородам по международной номенклатуре. СН3 СН3 – СН2 – С – СН3
- 13. Получение Из природного сырья (нефть, газ) – перегонка Крекинг нефтепродуктов C16H34 C8H18 + C8H16 C8H18 C4H10
- 14. Получение 5. Синтез Вюрца А) Симметричный t СН3Cl + 2Na + ClCH3→CH3-CH3 +2NaCl t 2CH3–CH2Br +
- 15. Синтез Вюрца 2CH3-СHBr-CH3+2Na→ CH3-CH-CH-CH3 +2NaBr │ │ CH3 CH3 2,3-диметилбутан Б) Несимметричный CH3-СHBr-CH3+2Na+BrCH3→CH3-CH-CH3 +2NaBr │ CH3
- 16. Задание: Получите алканы синтезом Вюрца и назовите их: А) 2-метил-2-хлорбутан Б) 2-метил-2-хлорбутан+бромэтан В) 1-бром-2,2-диметилбутан Г) 1-бром-2,2-диметилбутан+2-йод-2-метилпропан
- 17. Задание: Получите алканы синтезом Вюрца и назовите их: А) 2-метил-2-хлорбутан (3,3,4,4-тетраметилгексан) Б) 2-метил-2-хлорбутан+бромэтан (3,3-диметилпентан) В) 1-бром-2,2-диметилбутан
- 18. Получение Декарбоксилирование натриевых солей карбоновых кислот (реакция Дюма) t CH3COONa + NaOH→CH4 + Na2CO3 t CH3CH2COONa
- 19. 7. Метод Фишера-Тропша («оксосинтез») Синтез алканов из «синтез-газа» (СО и Н2) nCO+ (2n+1)H2→CnH2n+2+nH2O 5CO+ 11H2→C5H12+5H2O «Синтез-газ»
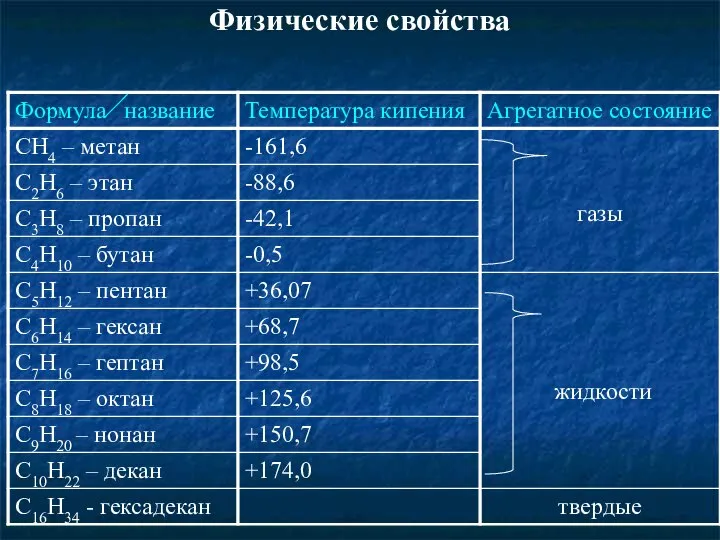
- 20. Физические свойства СН4 – С4Н10 – газы (метан, этан, пропан, бутан); С5Н12 – С15Н32- жидкости; С16Н34
- 21. Физические свойства
- 22. Химические свойства I. Радикальное замещение (SR) 1.1. Галогенирование CH4 + Cl2 свет CH3Cl + HCl CH3Cl
- 23. Химические свойства I. Радикальное замещение (SR) 1.2. Нитрование (р-я Коновалова) CH4 + HONO2 t CH3NO2 +
- 24. Химические свойства II. Разрушение цепи Изомеризация 2.1. CH3 – CH2 – CH2 – CH2 –CH3AlCl3, 4000
- 25. III. Отщепление 1. Дегидрирование 2. Ароматизация Химические свойства 3.1. CH3 – CH3 Pt,t0 CH2 = CH2
- 26. Химические свойства IV. Окисление
- 27. При недостатке кислорода алканы могут сгорать до угарного газа или с образованием сажи (коптят): 2СН4 +
- 28. 5. Алкилирование – объединение низших алканов и алкенов в высшие разветвлённые, имеющие октановое число более высокое,
- 29. Промышленная переработка метана: 1) Пиролиз CH4 to, 1000o C + 2H2 (пиролиз) 2) Конверсия (превращение) с
- 30. Нахождение в природе Метан – образуется в природе в результате разложения остатков растений и животных без
- 31. Применение Получение растворителей. Получение ацетилена. В металлургии. Горючее для дизельных и турбореактивных двигателей. А также сырьё
- 32. Применение алканов: Газообразные алканы (метан и пpопан-бутановая смесь) используются в качестве ценного топлива. Жидкие углеводоpоды составляют
- 34. Скачать презентацию


























 Строение атома
Строение атома Циклоалканы. Номенклатура и строение
Циклоалканы. Номенклатура и строение Липиды
Липиды Презентация на тему Спирты (10 класс)
Презентация на тему Спирты (10 класс)  Получение металлов
Получение металлов Предельные одноатомные спирты
Предельные одноатомные спирты Понятия и законы в химии. (Лекция 1)
Понятия и законы в химии. (Лекция 1) Презентация на тему Фолиевая кислота
Презентация на тему Фолиевая кислота  Оксиды
Оксиды Уран гексафториді
Уран гексафториді Состав и строение атома. Изотопы
Состав и строение атома. Изотопы 2.Химич. м-ды колич. ан-за
2.Химич. м-ды колич. ан-за Агрегатные состояния вещества
Агрегатные состояния вещества Применение углерода
Применение углерода Современные представления о строении атома
Современные представления о строении атома от греч. Hydro –вода, Lysis – разложение, распад Гидролиз – это реакция обменного разложения веществ водой
от греч. Hydro –вода, Lysis – разложение, распад Гидролиз – это реакция обменного разложения веществ водой Синтез поликонденсационных полимеров
Синтез поликонденсационных полимеров Соли
Соли Всё о нефти. Часть 5
Всё о нефти. Часть 5 Невидиме чорнило
Невидиме чорнило Функциональные свойства и анализ каротиноидов в пищевых продуктах
Функциональные свойства и анализ каротиноидов в пищевых продуктах Резиновые материалы и клеи. Тема 7.5
Резиновые материалы и клеи. Тема 7.5 Пайданалылған майларды қолдана отырып көмірді брикеттер алу
Пайданалылған майларды қолдана отырып көмірді брикеттер алу ОГЭ №1, вопрос 1-16
ОГЭ №1, вопрос 1-16 Пробоотбор и пробоподготовка
Пробоотбор и пробоподготовка Электролитическая диссоциация
Электролитическая диссоциация Углеводороды
Углеводороды Получение и реакции пиразина
Получение и реакции пиразина