Содержание
- 2. 1. Степень окисления атомов элементов 2. Окислительно-восстановительные реакции 3. Составление уравнений окислительно-восстановительных реакций: 3.1. Метод электронного
- 3. Заряд элемента, вычисленный исходя из предположения, что соединение состоит только из ионов. Степень окисления (СО) В
- 4. Реакции, в которых происходит изменение степеней окисления элементов Окислительно-восстановительные реакции Zn0 + 2HCl = ZnCl2 +
- 5. Типичные металлы : Al, Mg, Zn, Na, K… Соединения, в которых металл проявляет низшую СО: Fe+2Cl2
- 6. Важнейшие окислители Соединения высших степеней окисленности, присущих данному металлу: KMn+7O4, Fe+3Cl3, K2Cr2+6O7 2. F2, Cl2,Br2, I2,
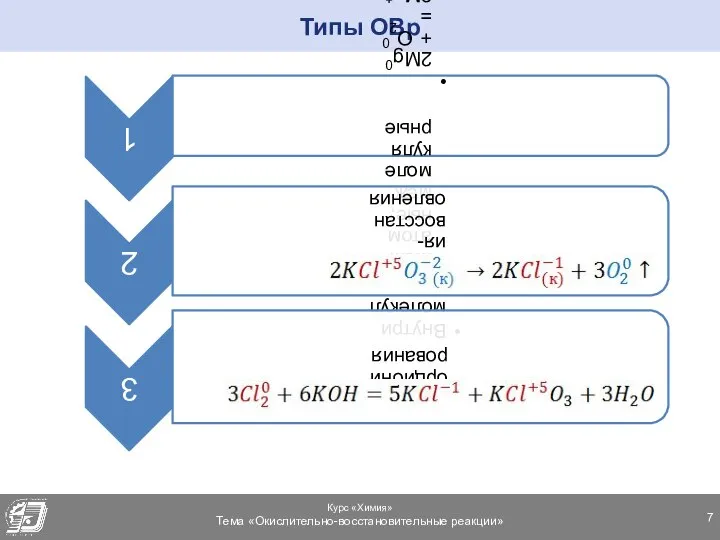
- 7. Типы ОВр
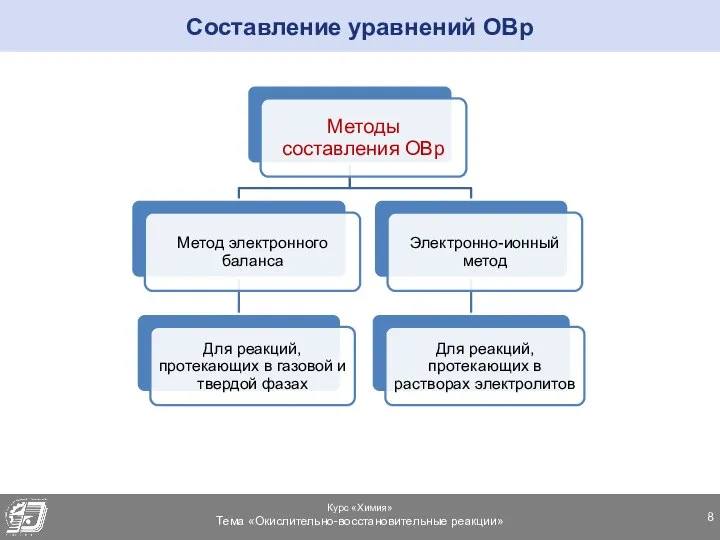
- 8. Составление уравнений ОВр
- 9. Метод электронного баланса Основан на сравнении СО атомов в исходных и конечных веществах – окислитель, –
- 10. Электронно-ионный метод (метод полуреакций) Овр в кислой среде 1. Определяем элементы, изменяющие СО 2. Определяем реально
- 11. Овр в кислой среде 4. Уравниваем заряды частиц: восстановление окисление 5. Определяем коэффициенты: 6. Суммируем с
- 12. Овр в нейтральной среде 1. Определяем элементы, изменяющие СО 2. Определяем реальные частицы 3. Уравниваем число
- 13. Овр в нейтральной среде 4. Уравниваем суммарное число зарядов 5. Подбираем коэффициенты 6. Складываем уравнения полуреакций
- 14. Овр в нейтральной среде 7. Сокращаем подобные члены 8. Уравнение в молекулярной форме 9. Проверяем количество
- 15. Овр в щелочной среде окисление восстановление
- 16. Овр в щелочной среде
- 17. Условие самопроизвольного протекания реакций Направление протекания ОВр F – постоянная Фарадея, 96500 Кл/моль Е – электродвижущая
- 18. Направление протекания ОВр MnO2 + 4HCl = MnCl2 + CI2 + 2H2O Возможна ли в стандартный
- 19. Направление протекания ОВр В стандартных условиях окисление НСl оксидом марганца (IV) термодинамически невозможно
- 20. Реакция фотосинтеза у растений и процессы дыхания у животных и человека. Процессы горения топлива, протекающие в
- 21. Химическое никелирование используется в электронной и вычислительной технике радиотехнике и автоматике электротехнике для получения печатных схем
- 22. 1. Любая окислительно-восстановительная реакция состоит из процессов окисления и восстановления. 2. В химических окислительно-восстановительных реакциях окисление
- 24. Скачать презентацию



















 Материаловедение и технология конструкционных материалов
Материаловедение и технология конструкционных материалов Температурная зависимость скорости химической реакции
Температурная зависимость скорости химической реакции Каучук. Строение и применение
Каучук. Строение и применение Классификация кислот
Классификация кислот Ионные уравнения реакций
Ионные уравнения реакций Коды Менделеева
Коды Менделеева Фенол. Физические свойства
Фенол. Физические свойства Тест 1 задание
Тест 1 задание Соли. Свойства. Получение
Соли. Свойства. Получение Презентация на тему Азотная кислота и её соли
Презентация на тему Азотная кислота и её соли  Применение серы
Применение серы рН розчину
рН розчину Тестирование по химии
Тестирование по химии Исследование интерактивной компьютерной химической модели
Исследование интерактивной компьютерной химической модели Вспомни… СаО, SО2, Fе2О3 , Nа2О, Сl2О7
Вспомни… СаО, SО2, Fе2О3 , Nа2О, Сl2О7 Аминокислоты. Викторина
Аминокислоты. Викторина Генетическая связь углеводородов, спиртов, альдегидов и карбоновых кислот
Генетическая связь углеводородов, спиртов, альдегидов и карбоновых кислот Презентация на тему Альдегиды и их свойства
Презентация на тему Альдегиды и их свойства  Карбоновые кислоты и их производные. (Лекция 11)
Карбоновые кислоты и их производные. (Лекция 11) Атом- сложная частица
Атом- сложная частица Аттестационная работа. Сколько наша семья потребляет энергоресурсов и выбрасывает углекислого газа
Аттестационная работа. Сколько наша семья потребляет энергоресурсов и выбрасывает углекислого газа Электролитическая диссоциация кислот
Электролитическая диссоциация кислот Нефть - природный источник углеводородов
Нефть - природный источник углеводородов Химия и автомобиль
Химия и автомобиль Строение атома углерода. 10 класс
Строение атома углерода. 10 класс Презентация на тему Основные понятия химии
Презентация на тему Основные понятия химии  Соль и ее свойства. Добыча соли
Соль и ее свойства. Добыча соли Гидролиз солей
Гидролиз солей