Слайд 2Ионная химическая связь это связь, образовавшаяся за счет электро-статического притяжения катионов к

анионам. Ионной связи соответствует ионная кристаллическая решетка. Задание: Выпишите формулы веществ с ионной связью и составьте для них схемы образования: РСl3; С2Н2; ССl4; MgCl2; СН4; K3N; NaBr.
Слайд 4Направленность связи - определённая локализация её в пространстве, определяет геометрию молекулы. Направленность

напрямую связана с гибридизацией орбиталей. Гибридизация обеспечивает: А) эквивалентность орбиталей; Б) наибольшее их перекрывание; В) максимальное удаление в пространстве друг от друга. Ионная и металлическая связь не обладают свойствами направленности и локализации в пространстве
Слайд 5Насыщаемость связи - образование атомом определенного количества ковалентных связей, ограниченного числом валентных

электронов
Слайд 6Ковалентная химическая связь это связь, возникающая между атомами за счет образования общих

электронных пар Примеры образования ковалентной неполярной связи
Слайд 7Полярность ковалентной связи - это степень смещенности общих электронных пар к одному

из связанных ими атомов Электроотрицательность (ЭО) — свойство атомов оттягивать к себе валентные электроны от других атомов Неполярная ковалентная связь образуется между атомами с одинаковой ЭО Полярная ковалентная связь образуется между атомами с разной ЭО H H H Br
Слайд 8Полярные молекулы - диполи Полярность молекулы зависит не только от полярность связей

в ней, но и от геометрической формы молекулы Дипольный момент – произведение заряда δ на длину диполя
Слайд 10Полярность ковалентной связи зависит от разности электроотрицательности связанных атомов ∆ H -

I H - Br H - Cl ЭО 2,1 2,5 2,1 2,8 2,1 3,0 ЭО 0,4 0,7 0,9 Полярность связей и молекул увеличивается
Слайд 11Донорно-акцепторный механизм образования ковалентной связи

Слайд 12Водородная связь Химическая связь между положительно поляризованными атомами водорода одной молекулы и

отрицательно поляризованными атомами сильно электроотрицательных элементов, имеющих неподеленные электронные пары (F, О, N), другой молекулы Задания: 1. Приведите примеры органических соединений, способных к образованию водородной связи; 2. Какие особые свойства придает водородная связь этим соединениям?
Слайд 14Кристаллические вещества с ковалентным типом связи атомная кристаллическая решетка, отличается высокой прочностью,

твердостью, тугоплавкостью другие примеры: Si, B, Ge, SiC- карборунд, SiO2 - кварц (песок) алмаз графит
Слайд 15Кристаллические вещества с ковалентным типом связи молекулярная кристаллическая решетка, вещества нестойкие, легкоплавкие,

летучие Примеры: Н2О - лед, P4, S8, I2 СО2 (твердый) – «сухой» лед СО2
Слайд 17Задания: 1. Определите типы химических связей между атомами в веществах: CaВг2; НСl;

К; H2SO4; BaO; SO2; LiNО3; S8; C2H2; Na; HCОOК.
Слайд 18Проверьте себя: Ионная: CaВг2; BaO; LiNО3; HCОOК. Металлическая: К; Na. 3. Ковалентная

полярная: НСl; H2SO4; SO2; C2H2. 4. Ковалентная неполярная: S8. 1.



















 Химический состав живых организмов. Метаболизм
Химический состав живых организмов. Метаболизм Исследование растворимости в системе уксусная кислота-этиловый спирт-этилацетат-вода методом изотермического титрования при 60˚C
Исследование растворимости в системе уксусная кислота-этиловый спирт-этилацетат-вода методом изотермического титрования при 60˚C Углеводороды
Углеводороды Альдегиды и кетоны
Альдегиды и кетоны Химия — это наука о веществах, их свойствах и превращениях
Химия — это наука о веществах, их свойствах и превращениях Вода… Химические названия
Вода… Химические названия Исследование реологических характеристик радиационносшитых водорастворимых полимеров с целью разработки новых составов для ГРП
Исследование реологических характеристик радиационносшитых водорастворимых полимеров с целью разработки новых составов для ГРП Кремний и его соединения
Кремний и его соединения Относительная атомная и молекулярная масса
Относительная атомная и молекулярная масса Водородные соединения неметаллов
Водородные соединения неметаллов Химическая связь и ее типы
Химическая связь и ее типы Углеводороды: изомерия
Углеводороды: изомерия Реакции ионного обмена
Реакции ионного обмена Стекло. Технология изготовления стекла
Стекло. Технология изготовления стекла Кристаллы
Кристаллы Вероятность протекания химических реакций
Вероятность протекания химических реакций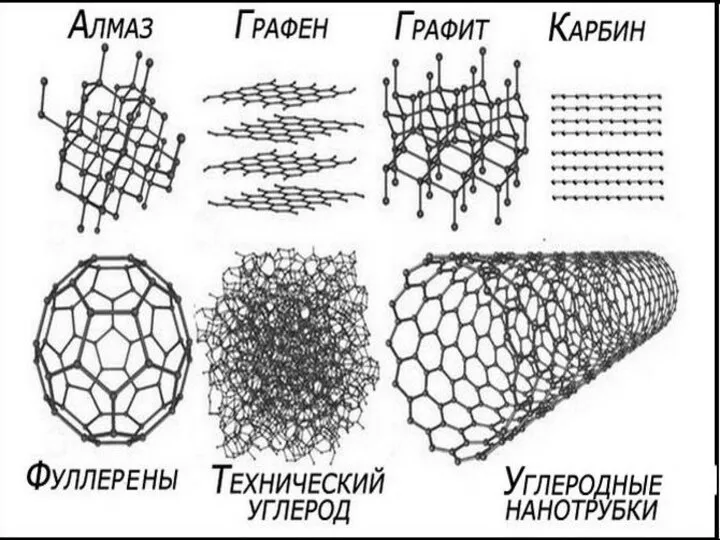 Углеродные нанотрубки
Углеродные нанотрубки Подача питательной воды в парогенератор при запроектной аварии
Подача питательной воды в парогенератор при запроектной аварии Соединения железа. 9 класс
Соединения железа. 9 класс Premeny látok. Požiar a jeho hasenie
Premeny látok. Požiar a jeho hasenie Понятие электродного потенциала и методы его измерения
Понятие электродного потенциала и методы его измерения Стеклоткани. Виды стеклотканей
Стеклоткани. Виды стеклотканей Типы химических реакций в органической химии
Типы химических реакций в органической химии Роль элементов 5 группы
Роль элементов 5 группы Амины. Аминокислоты. Белки. (Лекция 8)
Амины. Аминокислоты. Белки. (Лекция 8) Железо 11 класс - Презентация_
Железо 11 класс - Презентация_ Презентация по Химии "Соединения алюминия"
Презентация по Химии "Соединения алюминия"  Кремневая кислота и ее соли
Кремневая кислота и ее соли