Содержание
- 2. Кинетика – раздел химии, изучающий скорость и механизм протекания реакций. Задачи химической кинетики: 1. количественное описание
- 3. Объектом изучения кинетики является система. Система – совокупность материальных объектов (веществ или частиц), находящихся во взаимодействии,
- 4. Система может иметь реальную или воображаемую границу. Пример: Cтеклянные стенки стакана, в котором слиты растворы реагирующих
- 5. Фаза – однородная часть системы, одинаковая во всех своих точках по химическому составу и свойствам и
- 6. Обозначения: (т) — твердое; (к) — кристаллическое (ж) — жидкое (г) — газообразное
- 7. В зависимости от числа фаз системы бывают: гомогенные (однородные); гетерогенные, состоящие из 2-х или более фаз.
- 8. Примеры: Открытая: разбавленный р-р серной кислоты в открытом стакане. В зависимости от t-ры вода будет либо
- 9. Состояние любой системы характеризуется набором определённых параметров – Т, Р, V, С. Параметры состояния – условия
- 10. ПРОЦЕСС – это любое изменение хотя бы одного из параметров системы. Если при переходе системы из
- 11. исходные в-ва продукты р-ции р е а г и р у ю щ и е в
- 12. Простые реакции — протекают в одну стадию, их стехиометрические уравнения правильно отражают реальный ход процесса. Сложные
- 13. Классификация процессов В зависимости от наличия или отсутствия энергетических затрат процессы бывают: Самопроизвольные Вынужденные Циклические В
- 14. В зависимости от обратимости процессы бывают: Необратимые – идущие до конца, т.е. исх. вещества полностью превращаются
- 15. В зависимости от агрегатного состояния процессы бывают: Гомогенные – протекают во всем объеме, реагирующие вещества находятся
- 16. Любая хим. реакция сопровождается разрушением имеющихся в веществе связей и образованием новых. Энергия связей превращается в
- 17. В зависимости от теплового эффекта процессы бывают: эндотермические – поглощение теплоты ∆Н > 0, Q экзотермические
- 18. Качественно скорость реакции можно оценить по изменению внешнего признака реакции – изменению цвета, выделению газа, выпадению
- 19. Для количественной оценки в кинетике используются понятия средней, относительной и мгновенной скорости р-ции. На практике чаще
- 20. Скорость гомогенных реакций измеряется количеством вещества системы, вступающего в реакцию или образующегося в результате реакции в
- 21. Скорость гетерогенных реакций измеряется количеством вещества системы, вступающего в реакцию или образующегося за единицу времени на
- 22. !!! Скорость реакции зависит от: 1) природы реагирующих веществ; 2) условий протекания реакции – концентраций реагентов,
- 23. Зависимость скорости реакции от концентрации реагирующих веществ !!! Закон действующих масс (ЗДМ) – скорость гомогенной химической
- 24. Для реакции аА + bВ = сС + dD где — скорость реакции; k — константа
- 25. В газовой смеси парциальное давление каждого газа пропорционально числу молекул этого газа, содержащихся в данном объеме.
- 26. Пример. Гомогенная реакция: или
- 27. Физический смысл зависимости скорости реакции от концентрации реагирующих в-в: В химической кинетике исходят из положения, что
- 28. Физический смысл k: Константа скорости показывает, с какой скоростью идет реакция при концентрациях реагирующих веществ, равных
- 29. Химический смысл k: Константа скорости является количественной мерой реакционной способности молекул. Число реагирующих молекул и число
- 30. !!! Константа скорости зависит от: !!! Константа скорости не зависит от: Факторы, влияющие на константу скорости:
- 31. ЗДМ справедлив только для простых реакций. Для сложных реакций ЗДМ справедлив для каждой отдельной стадии, но
- 32. Стадии гетерогенной реакции: 1) процесс переноса (диффузия) исходных веществ к поверхности раздела фаз; 2) адсорбция (осаждение)
- 33. Концентрации твердых веществ постоянны и включены в константу скорости, поэтому в уравнение ЗДМ входят только концентрации
- 34. Пример. Гетерогенная реакция: или
- 35. Пример: Как изменится скорость реакции, если: а) увеличить давление в системе в 3 раза; б) уменьшить
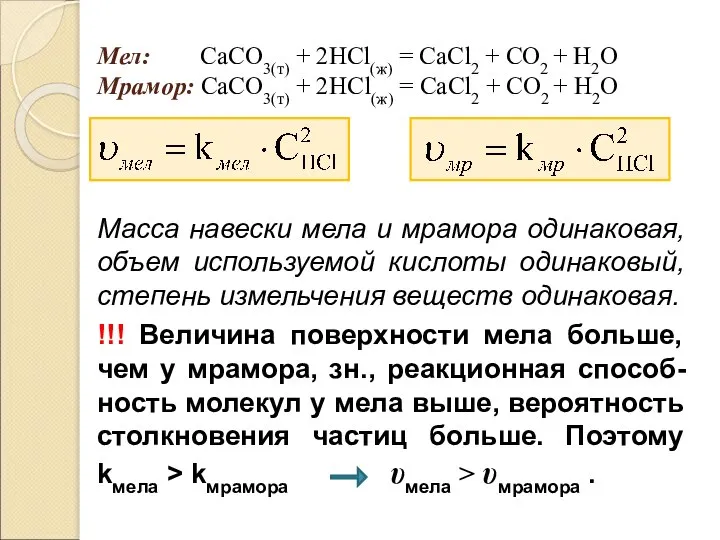
- 36. Зависимость скорости гетерогенной реакции от величины поверхности реагирующих веществ Скорость реакции в гетерогенных процессах пропорциональна поверхности
- 37. Мел: СаCО3(т) + 2HCl(ж) = СаCl2 + СO2 + H2O Мрамор: СаCО3(т) + 2HCl(ж) = СаCl2
- 38. Зависимость скорости реакции от температуры При повышении температуры скорость реакции увеличивается. Для количественного описания температурных эффектов
- 39. !!! Правило Вант-Гоффа При повышении температуры на 10 градусов скорость большинства реакций увеличивается в 2 –
- 40. ΔТ = Т2 – Т1; γ (гамма) – температурный коэффициент скорости реакции (значение от 2 до
- 41. Следовательно, Физичекий смысл γ : коэффициент показывает, во сколько раз увеличивается скорость реакции при повышении температуры
- 42. Между скоростью протекания химических реакций и их продолжительностью существует обратно пропорциональная зависимость:
- 43. Пример: Во сколько раз возрастет скорость реакции при повышении температуры с 10 до 30 °С (γ
- 44. Уравнение Аррениуса При переходе от натурального логарифма к десятичному: или
- 45. k – константа скорости; А – предэкспоненциальный множитель; е – основание натурального логарифма, е=2,72; Еа –
- 46. Предэкспоненциальный множитель А – постоянная величина для каждой конкретной реакции, характеризует общее число столкновений с благоприятной
- 47. По теории Аррениуса к химическому взаимодействию приводят не все столкновения, а столкновения только активных молекул –
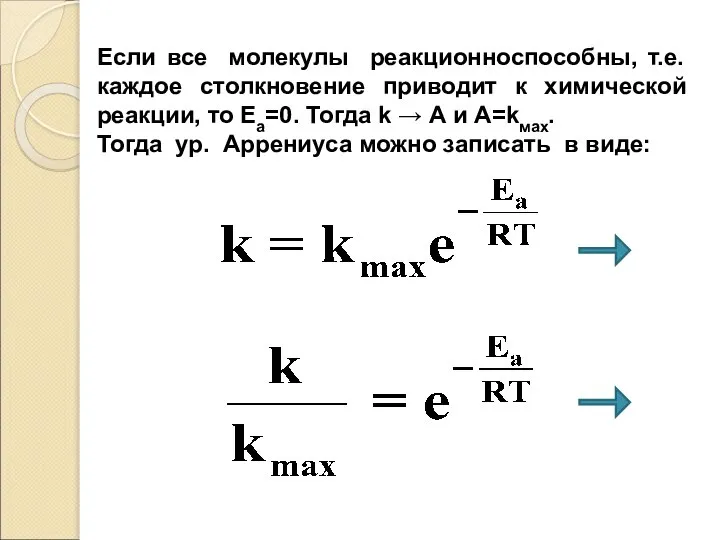
- 48. Если все молекулы реакционноспособны, т.е. каждое столкновение приводит к химической реакции, то Ea=0. Тогда k →
- 49. Физический смысл экспоненциального множителя: определяет отношение фактической скорости реакции при заданной температуре и единичных концент-рациях к
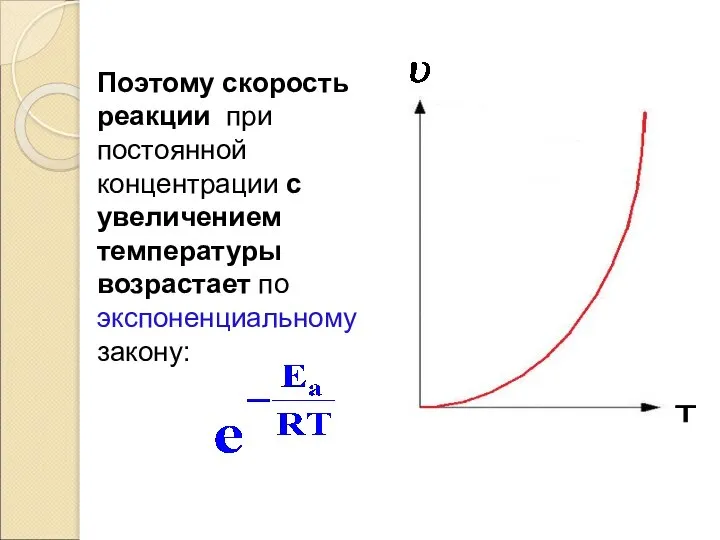
- 50. 1) Повышение температуры увеличивает значение экспоненциального множителя, т.е. повышение температуры вызывает резкое увеличение числа активных молекул.
- 51. Поэтому скорость реакции при постоянной концентрации с увеличением температуры возрастает по экспоненциальному закону: T
- 52. Вывод: К химическому взаимодействию приводят столкновения только активных молекул – частиц, запас энергии которых больше или
- 53. 2) Уравнение Аррениуса позволяет рассчитать: — как изменится скорость реакции при известном изменении температуры и значении
- 54. Пример: Скорость некоторой химической реакции при повышении температуры от 300 до 400 К возросла в 210
- 55. 3) Чем больше значение энергии активации, тем меньше скорость реакции. 4) С увеличением температуры в большей
- 56. Пример: При некоторой постоянной температуре Т1 протекают две реакции: 1-я : k'Т1 и Еа1 = 40
- 57. 5) Есть две принципиальные возможности ускорения химической реакции: увеличение температуры; снижение Ea с помощью катализатора. Введение
- 58. Энергия активации Величина Ea определяет высоту энергетического барьера реакции. Энергетический барьер реакции — энергетический уровень реакции
- 59. По пути из исходного состояния в конечное система должна преодолеть энергетический барьер. Только активные молекулы, обладающие
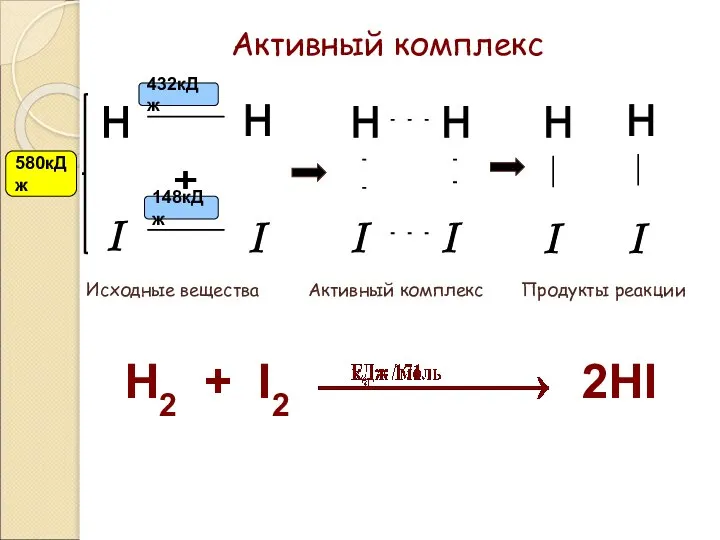
- 60. Преодоление энергетического барьера частицами исходных веществ связано с образованием активного (переходного) комплекса. Активный комплекс — группа
- 61. Активный комплекс H I - + . H I H H I I . . .
- 62. Энергетическая диаграмма реакции — описание хода реакции через изменение энергии исходных веществ. Ось абсцисс в диаграмме
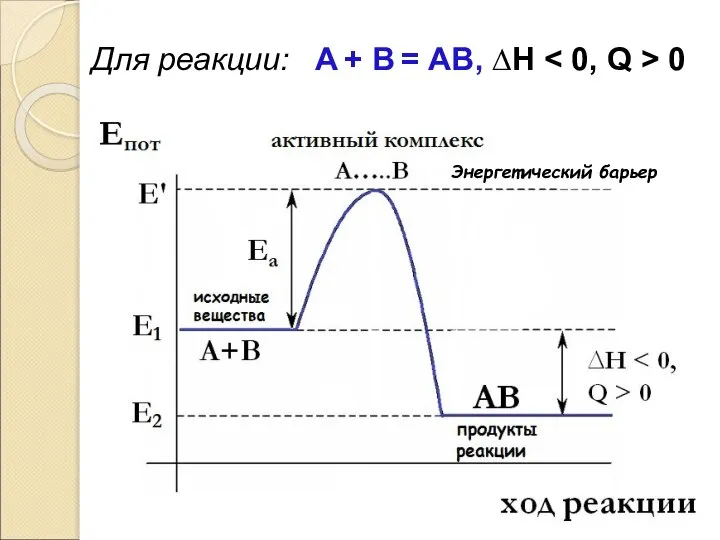
- 63. Для реакции: А + В = АВ, ∆Н 0 Энергетический барьер
- 64. Е’ – энергия активного комплекса, соответствует максимальному значению потенциальной энергии системы на пути реакции, поэтому он
- 65. В отсутствие катализаторов энергия активного комплекса Eа велика. Катализатор изменяет строение активного комплекса, при этом его
- 67. Скачать презентацию



























































 Растворы. Определение
Растворы. Определение Особо чистые вещества. Занятие13
Особо чистые вещества. Занятие13 Общая характеристика нефти и газа
Общая характеристика нефти и газа Углеродные материалы. Основные понятия и определения. Области их применения
Углеродные материалы. Основные понятия и определения. Области их применения Проверочные работы по темам: Неметаллы. 9 класс
Проверочные работы по темам: Неметаллы. 9 класс Повторение пройденного
Повторение пройденного Сильные и слабые кислоты и основания
Сильные и слабые кислоты и основания Пептиды, белки. Лабораторное занятие
Пептиды, белки. Лабораторное занятие Кристаллы и аморфные тела
Кристаллы и аморфные тела Презентация на тему Жидкие кристаллы
Презентация на тему Жидкие кристаллы  Физическая химия, термодинамика
Физическая химия, термодинамика Периодический закон Д.И.Менделеева
Периодический закон Д.И.Менделеева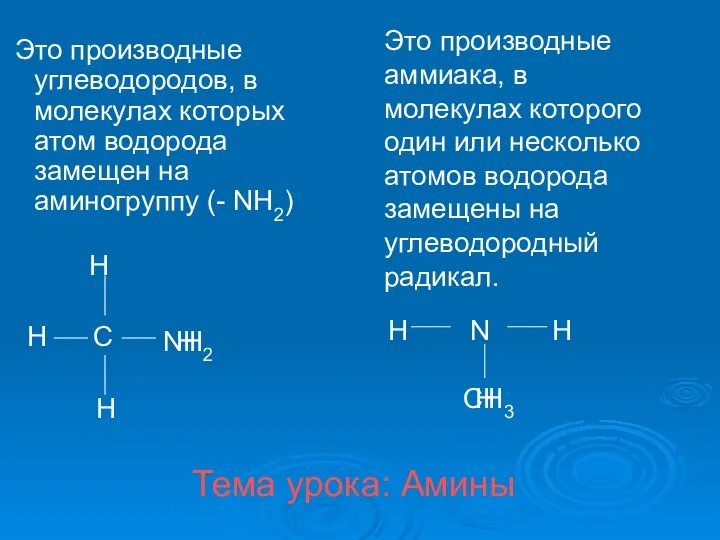 Амины. Классификация аминов
Амины. Классификация аминов Предмет органической химии. Теория химического строения органических веществ. 9 класс
Предмет органической химии. Теория химического строения органических веществ. 9 класс Химические равновесия в растворах. Константы равновесия при различном выборе стандартных состояний для участников реакции
Химические равновесия в растворах. Константы равновесия при различном выборе стандартных состояний для участников реакции Белки-1 2020
Белки-1 2020 Химические свойства металлов
Химические свойства металлов Химическая коррозия
Химическая коррозия Дигибридное скрещивание.Третий закон Г.Менделя.
Дигибридное скрещивание.Третий закон Г.Менделя. Металлы тоже воевали… 8 класс
Металлы тоже воевали… 8 класс Спирты
Спирты Повторение по теме: « Химическая связь. Строение вещества». Виды химических связей Типы кристаллических
Повторение по теме: « Химическая связь. Строение вещества». Виды химических связей Типы кристаллических Способы разделения смесей. Урок в 8 классе
Способы разделения смесей. Урок в 8 классе Сказка о братьях карбонатах
Сказка о братьях карбонатах Оксидті шикізаттан темір ұнтағын алу технологиясын жасау
Оксидті шикізаттан темір ұнтағын алу технологиясын жасау Сахароза (С12Н22О11)
Сахароза (С12Н22О11) Тест по неметаллам
Тест по неметаллам Строение комплексных соединений. Лекция 4
Строение комплексных соединений. Лекция 4