Содержание
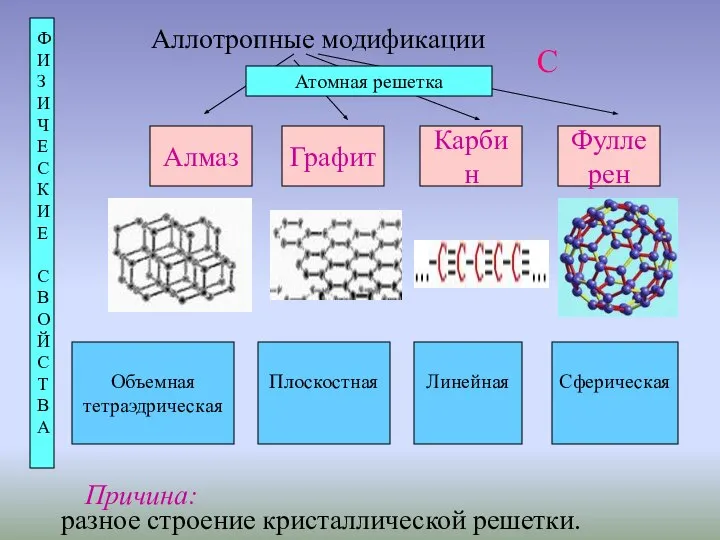
- 3. Аллотропные модификации Алмаз Графит Карбин Фулле рен Атомная решетка разное строение кристаллической решетки. Причина: Ф И
- 4. Алмаз Бесцветный Прозрачный Не проводит эл. ток Прочный Твердый При сгорании – углекислый газ О Б
- 5. Графит Темно-серый Непрозрачный Проводит эл. ток Мало прочный Мягкий Металлический блеск Оставляет след на бумаге Жирный
- 6. Карбин Карбин представляет собой порошок глубокого чёрного цвета с вкраплением более крупных частиц.По электрической проводимости карбин
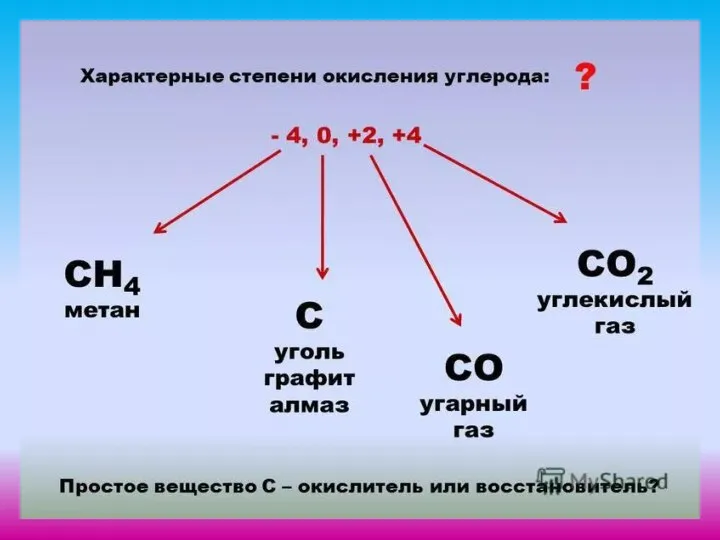
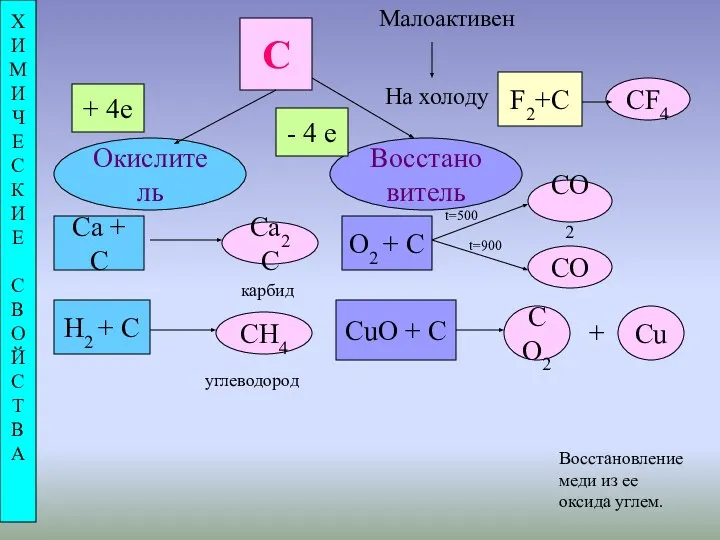
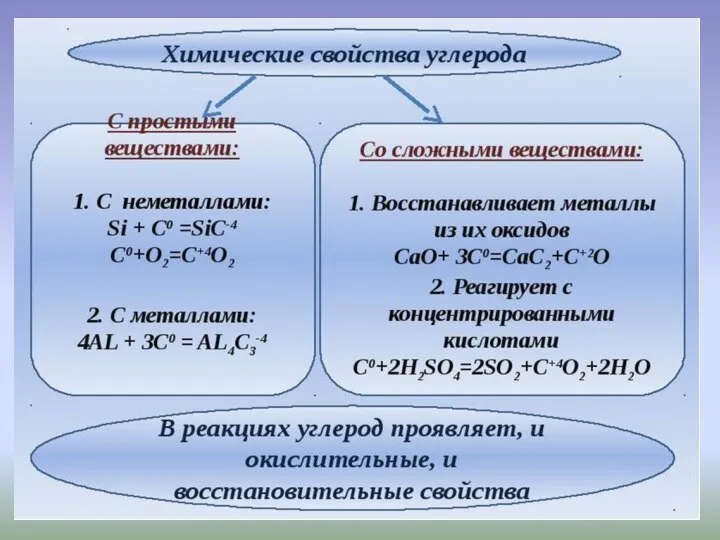
- 7. С Малоактивен На холоду Окислитель Восстановитель Х И М И Ч Е С К И Е
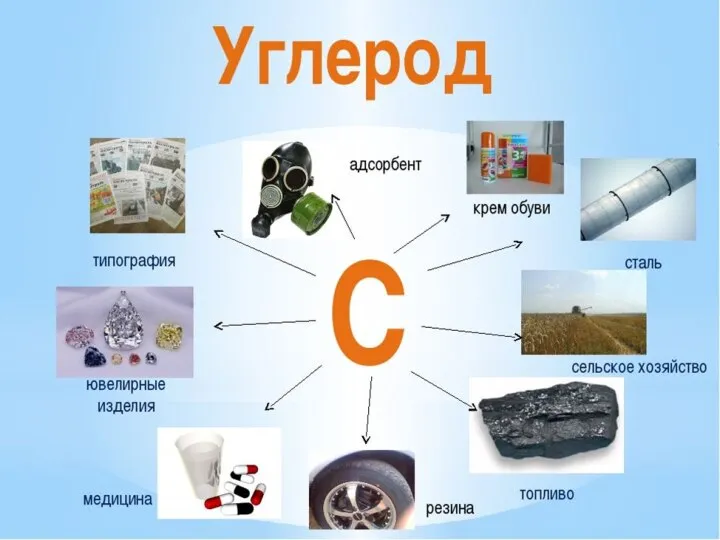
- 9. Адсорбция - свойство углерода удерживать на пористой поверхности растворенные вещества и газы Н. Д. Зелинский На
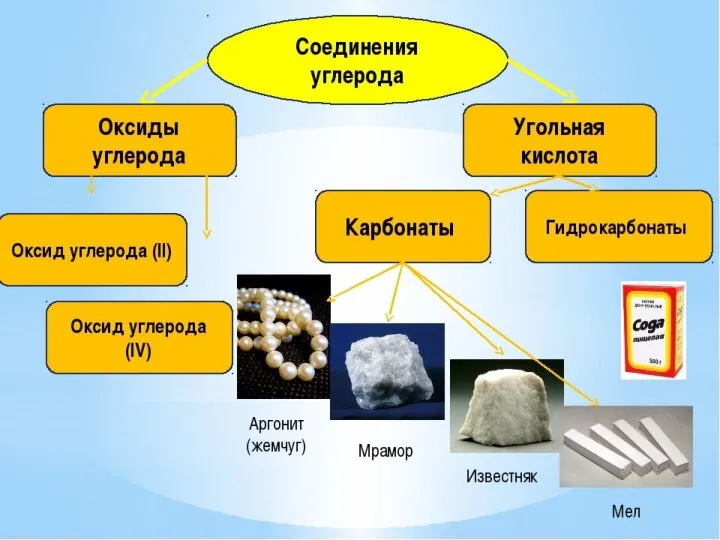
- 15. Угольная кислота Химическая формула - H2CO3 Структурная формула – все связи ковалентные полярные Кислота слабая, существует
- 16. Угольная кислота Двухосновная, образует соли: -средние – карбонаты (ионы CO32-) - кислые – гидрокарбонаты (ионы НCO3-)
- 18. Скачать презентацию









 Творческий отчет кружка Юные химики
Творческий отчет кружка Юные химики Белки
Белки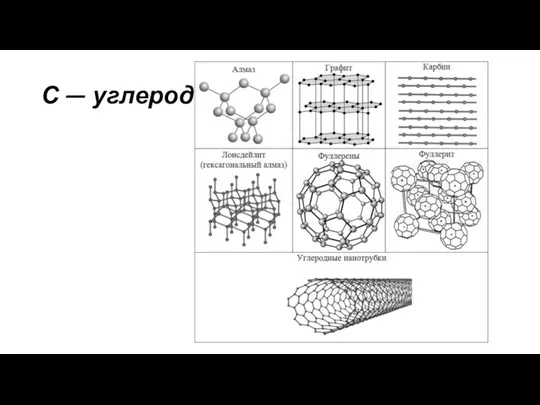 С - углерод. Применение
С - углерод. Применение Презентация на тему Алмаз, графит и фуллерен
Презентация на тему Алмаз, графит и фуллерен  Цветные металлы и сплавы
Цветные металлы и сплавы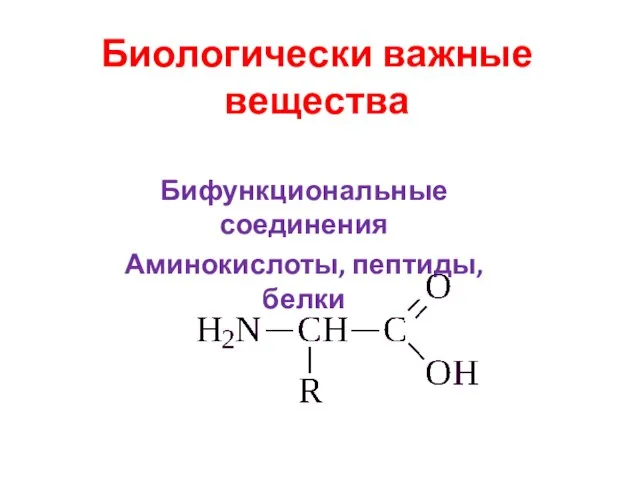 Биологически важные вещества. Бифункциональные соединения. Аминокислоты, пептиды, белки
Биологически важные вещества. Бифункциональные соединения. Аминокислоты, пептиды, белки Кислоты, их классификация и свойства
Кислоты, их классификация и свойства Решение расчетных задач на нахождение химической формулы вещества
Решение расчетных задач на нахождение химической формулы вещества Ацилирование. Лекция 4
Ацилирование. Лекция 4 Алмашу реакциясе
Алмашу реакциясе Пористые стекла
Пористые стекла Строение и химический состав костей, рост костей
Строение и химический состав костей, рост костей Министерство сельского хозяйства Российской Федерации. Поляграфия и фотоэлектронная спектроскопия
Министерство сельского хозяйства Российской Федерации. Поляграфия и фотоэлектронная спектроскопия Презентация на тему Производство аммиака
Презентация на тему Производство аммиака  Учебное задание Расчет теплоты сгорания
Учебное задание Расчет теплоты сгорания Тела и вещества. Химический диктант
Тела и вещества. Химический диктант Реакции нуклеофильного присоединения с участием карбонильной группы
Реакции нуклеофильного присоединения с участием карбонильной группы Дисперсные системы
Дисперсные системы Полезные ископаемые
Полезные ископаемые Процестер және аппараттар курсының пәні (1 дәріс)
Процестер және аппараттар курсының пәні (1 дәріс) Типы химических реакций. Решение примеров
Типы химических реакций. Решение примеров Химия в быту
Химия в быту Zirconium Dioxide
Zirconium Dioxide Фосфорні добрива. Технології збагачення фосфоровмісної сировини
Фосфорні добрива. Технології збагачення фосфоровмісної сировини Неметаллы. Обобщение и систематизация знаний
Неметаллы. Обобщение и систематизация знаний Химия в загадках
Химия в загадках Алканы. Бутан - С4Н10
Алканы. Бутан - С4Н10 Химический состав молока
Химический состав молока