Содержание
- 2. Цель урока: Задачи урока: Расширить и углубить знания об этиленовых углеводородах. показать различия между классами алканов
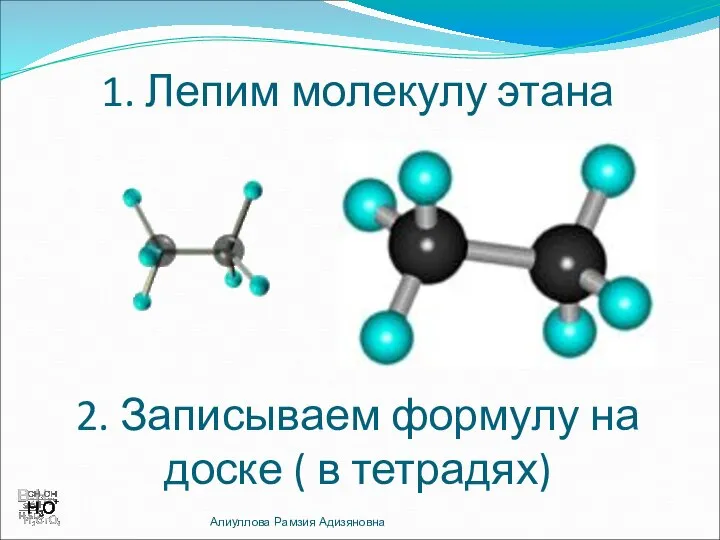
- 3. 1. Лепим молекулу этана 2. Записываем формулу на доске ( в тетрадях) Алиуллова Рамзия Адизяновна
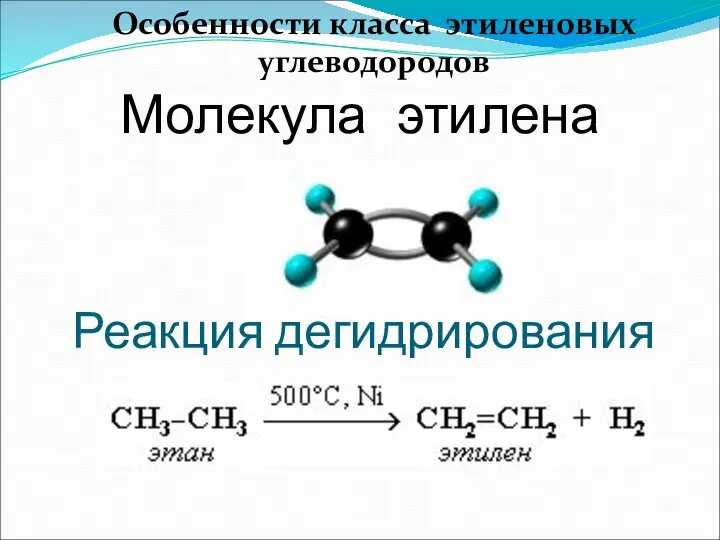
- 4. Молекула этилена Реакция дегидрирования Особенности класса этиленовых углеводородов
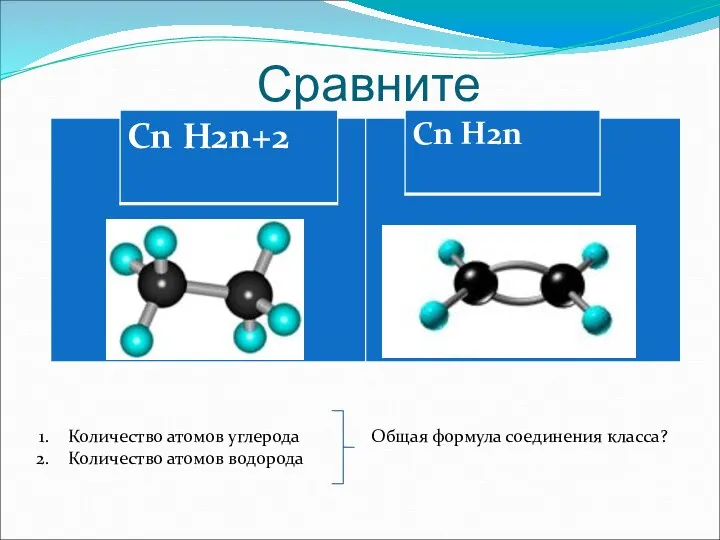
- 5. Сравните Количество атомов углерода Общая формула соединения класса? Количество атомов водорода
- 6. Алкены (этиленовые углеводороды) - непредельные углеводороды, содержащие в молекуле , кроме одинарных связей, одну двойную углерод
- 7. Задание на закрепление общей формулы: Какие из приведенных углеводородов относятся к алкенам? C4H8, C8H18, C6H6, C3H6,
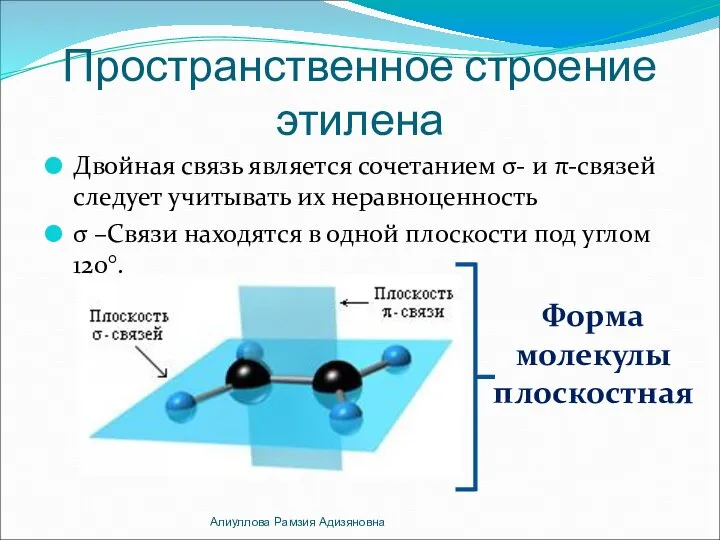
- 8. Пространственное строение этилена Двойная связь является сочетанием σ- и π-связей следует учитывать их неравноценность σ –Связи
- 9. Номенклатура алкенов По систематической номенклатуре названия алкенов производят от названий соответствующих алканов (с тем же числом
- 10. Назовите вещества
- 11. Структурная изомерия алкенов 1. Изомерия углеродного скелета (начиная с С4Н8): 2. Изомерия положения двойной связи (начиная
- 12. Замените на модели молекулы этилена два атома водорода на два атомы хлора у каждого атома углерода
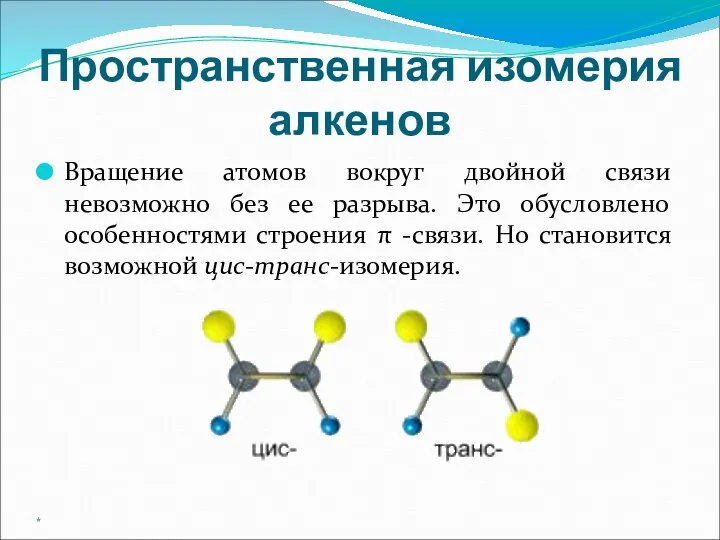
- 13. Пространственная изомерия алкенов Вращение атомов вокруг двойной связи невозможно без ее разрыва. Это обусловлено особенностями строения
- 14. Физические свойства алкенов Закономерно изменяются в гомологическом ряду: от С2Н4 до С4Н8 – газы, с С5Н10
- 15. Физкультминутка Красноперова Оксана Викторовна *
- 16. Химические свойства алкенов Определяются строением и свойствами двойной связи С=С. 1. Реакция присоединения
- 17. Правило Марковникова Русский химик-органик. В реакциях присоединения полярных молекул к несимметричным алкенам водород присоединяется к более
- 18. 2. Реакция полимеризации
- 19. Реакция окисления Мягкое окисление алкенов водным раствором перманганата калия приводит к образованию двухатомных спиртов (реакция Вагнера):
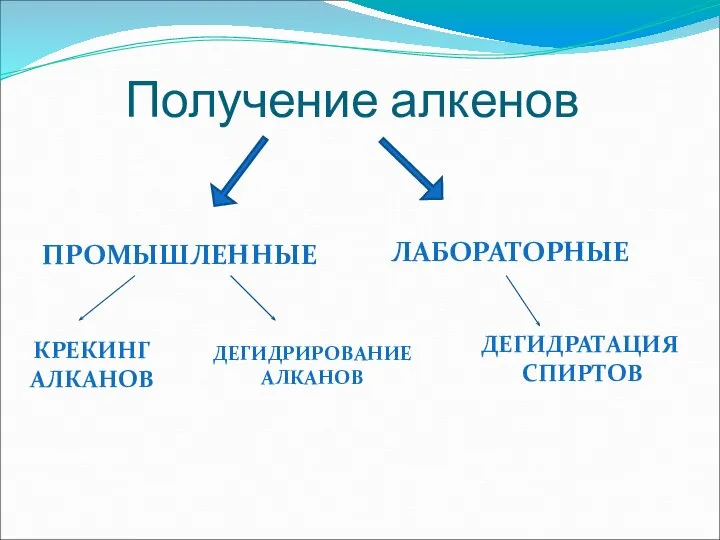
- 20. Получение алкенов ПРОМЫШЛЕННЫЕ ЛАБОРАТОРНЫЕ КРЕКИНГ АЛКАНОВ ДЕГИДРИРОВАНИЕ АЛКАНОВ ДЕГИДРАТАЦИЯ СПИРТОВ
- 22. Скачать презентацию













 Строение электронных оболочек атомов
Строение электронных оболочек атомов Введение в химию. Вещества. Факультатив по химии для учащихся 7 класса
Введение в химию. Вещества. Факультатив по химии для учащихся 7 класса Спирты и фенолы
Спирты и фенолы Ионные уравнения реакций
Ионные уравнения реакций Разбор задач
Разбор задач Звездный час по химии
Звездный час по химии Строение углеводородов
Строение углеводородов Спирты (алканолы)
Спирты (алканолы) Лабораторное оборудование. Тесты
Лабораторное оборудование. Тесты Аминокислоты. Общая формула
Аминокислоты. Общая формула Тефлон
Тефлон Применение солей
Применение солей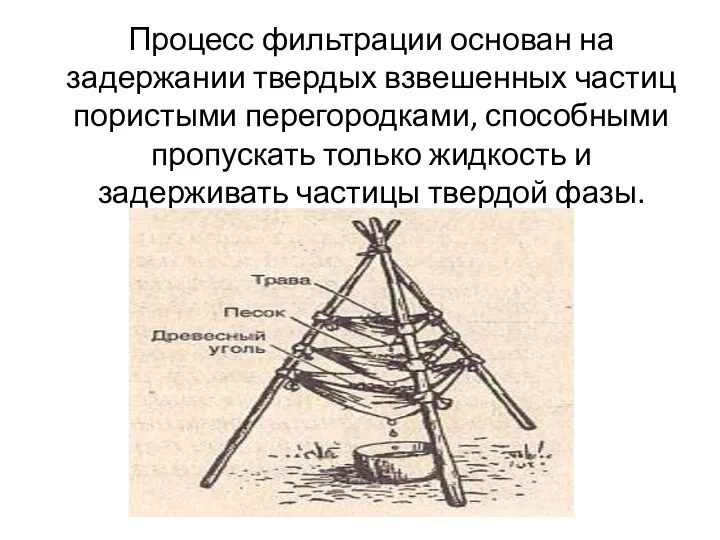 Процесс фильтрации - задержание твердых взвешенных частиц
Процесс фильтрации - задержание твердых взвешенных частиц Ориентация полимеров
Ориентация полимеров 4_Жиры 2020
4_Жиры 2020 Искусство фотографии и химия
Искусство фотографии и химия Метод ТРИЗ (теория решения изобретательских задач) при обучении химии
Метод ТРИЗ (теория решения изобретательских задач) при обучении химии Презентация на тему Нанотехнологии в химии
Презентация на тему Нанотехнологии в химии  Способы получения металлов
Способы получения металлов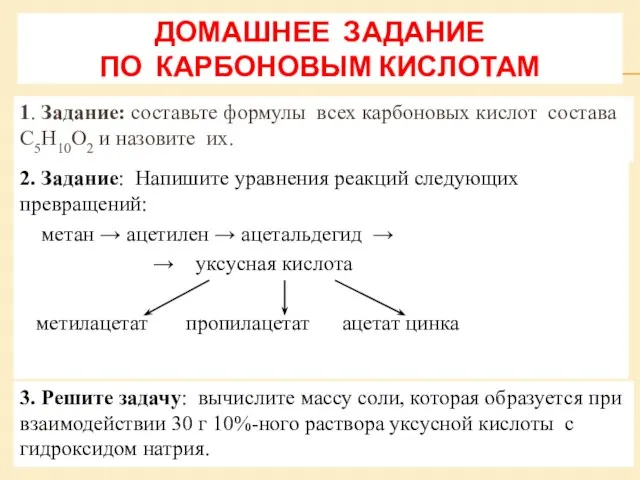 Карбоновые кислоты
Карбоновые кислоты 9 кл Урок 7 Розчинність речовин
9 кл Урок 7 Розчинність речовин Исследование свойств модельной смеси сополимера Акритана-С с ЛД-70
Исследование свойств модельной смеси сополимера Акритана-С с ЛД-70 Углеводороды. 9 класс
Углеводороды. 9 класс Биогаз. Технология производства
Биогаз. Технология производства proverochnaya_zadachi_1_ball_-_kopia (1)
proverochnaya_zadachi_1_ball_-_kopia (1) Порядок в жидкостях
Порядок в жидкостях Химический элемент Франций (Fr)
Химический элемент Франций (Fr) Алкены (олефины)
Алкены (олефины)