Содержание
- 2. Цели и задачи урока: Дать определение данному типу реакций Показать алгоритм записи о-в реакции Дать понятия
- 3. Содержание Роль ОВР в современном мире Основные понятия Расчет степени окисления Творческое задание Домашнее задание Сочиняют
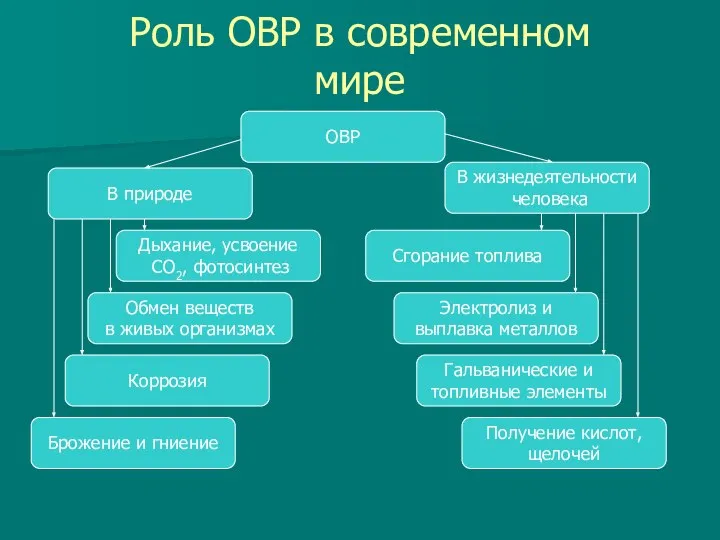
- 4. Роль ОВР в современном мире В природе ОВР В жизнедеятельности человека Дыхание, усвоение CO2, фотосинтез Сгорание
- 5. Основные понятия окислительно-восстановительная реакция степень окисления окислитель восстановитель процесс окисления-восстановления
- 6. Расчет степени окисления Следует запомнить: 1. Степени окисления атомов в простых веществах равны нулю: Na0; H20
- 7. Расчет степени окисления 1. Для веществ из двух элементов: -поставить постоянную степень окисления CO-2 -рассчитать степень
- 8. Расчет степени окисления 2.Для веществ из трех и более элементов: -поставить постоянные степени окисления H+1MnO4-2 -рассчитать
- 9. Творческое задание: ОВР в технике и жизни Задание для двух команд: Внимательно изучить представленную на слайде
- 10. Творческое задание 1 3 3 4 2 4 5 6 7 8 9 10 11 14
- 11. Домашнее задание 1. §57,59,61 – учебника 8 класса №10.40-10.42 , Хомченко И.Г. «Сборник задач и упражнений
- 12. Сочиняют дети…. Окислитель, как отъявленный злодей, Как пират, бандит, агрессор, Бармалей, Отнимает электроны - и OK!
- 13. Окислительно-восстановительные реакции Реакции, протекающие с изменением степени окисления, называются окислительно-восстановительными реакциями. 0 +2 0 +2 Cu
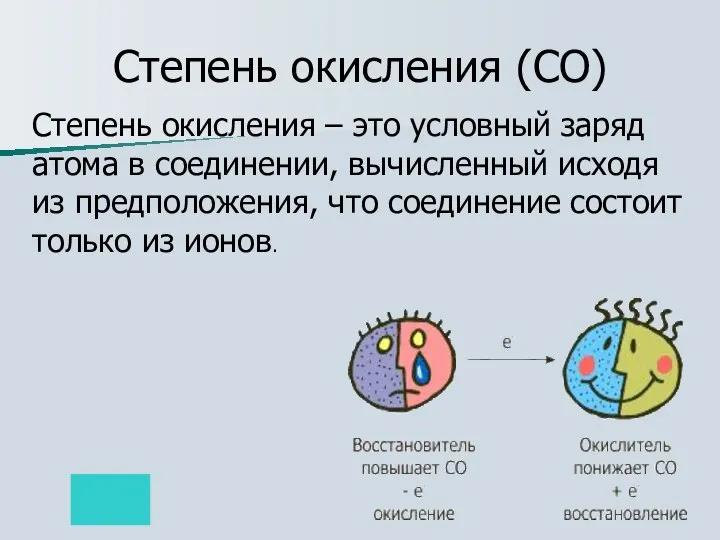
- 14. Степень окисления (СО) Степень окисления – это условный заряд атома в соединении, вычисленный исходя из предположения,
- 15. Окислитель -Частица (атом, ион), которая в ходе окислительно-восстановительного процесса принимает электроны называется окислителем -Простые вещества -
- 16. Типичные окислители К ним относятся многие сложные и простые вещества KClO3, F2, H2SO4 (конц.), Cl2, HNO3,
- 17. Восстановитель Частица (атом, ион), которая в ходе окислительно-восстановительного процесса отдает электроны, называется восстановителем Типичные восстановители
- 18. Типичные восстановители К ним также относятся простые и сложные вещества H2, KI, C (графит), HCl (конц.),
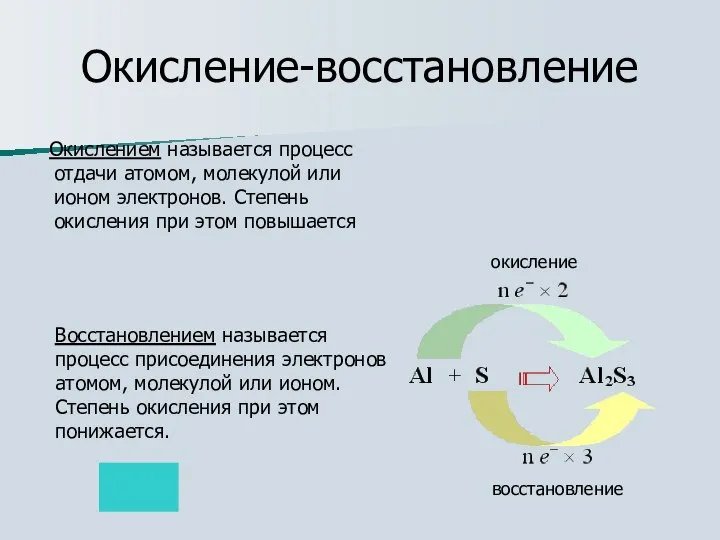
- 19. Окисление-восстановление окисление Окислением называется процесс отдачи атомом, молекулой или ионом электронов. Степень окисления при этом повышается
- 20. Окисление-процесс отдачи электронов 0 +2 Cu – 2 e- = Cu При окислении степень окисления элемента
- 22. Скачать презентацию
















 Идентификация С-конца ПП цепи
Идентификация С-конца ПП цепи Кристаллическая структура вещества. Характеристика вещества по формуле
Кристаллическая структура вещества. Характеристика вещества по формуле Соединения азота
Соединения азота Презентация на тему Все о спиртах
Презентация на тему Все о спиртах  Составление химических формул по валентности
Составление химических формул по валентности Хлордың қолданылуы
Хлордың қолданылуы Организация физической защиты ДРМ
Организация физической защиты ДРМ Углеводороды
Углеводороды Ковалентная неполярная связь
Ковалентная неполярная связь Основы неорганической химии
Основы неорганической химии Основания. 8 класс
Основания. 8 класс Физическая химия растворов электролитов
Физическая химия растворов электролитов Неорганосфера. Неметаллы
Неорганосфера. Неметаллы Магний и его сплавы
Магний и его сплавы Основания, их классификация и свойства в свете теории электролитической диссоциации
Основания, их классификация и свойства в свете теории электролитической диссоциации Турнир знатоков химии. Химическая лихорадка
Турнир знатоков химии. Химическая лихорадка Основы кристаллографии
Основы кристаллографии Презентация на тему Алкены
Презентация на тему Алкены  Химическая кинетика
Химическая кинетика Адсорбция и смачивание
Адсорбция и смачивание електроліти та неелектроліти
електроліти та неелектроліти Растворы
Растворы Способы выражения концентраций растворов
Способы выражения концентраций растворов Товароведение и экспертиза пластических масс и изделий из них
Товароведение и экспертиза пластических масс и изделий из них Классы неорганических соединений Подготовка к ЕГЭ
Классы неорганических соединений Подготовка к ЕГЭ Оксиды
Оксиды Микроструктура железоуглеродистых сплавов в равновесном состоянии
Микроструктура железоуглеродистых сплавов в равновесном состоянии Лаборатория мечты
Лаборатория мечты