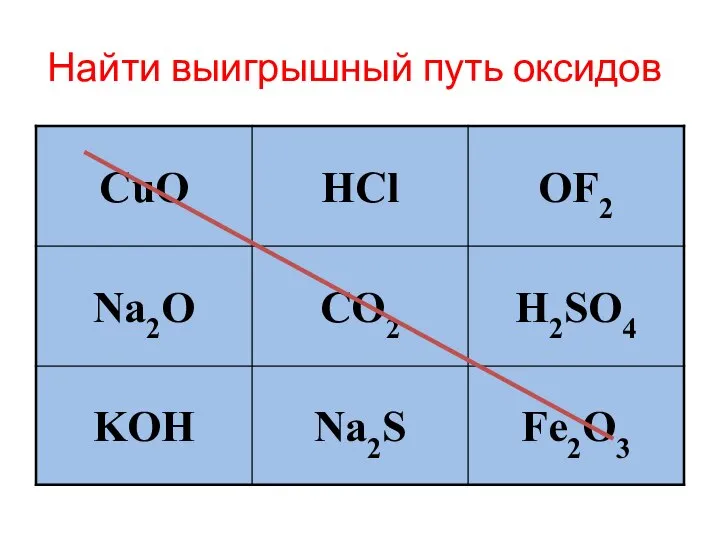
Слайд 2Найти выигрышный путь оксидов:
Слайд 7Сравните качественный и количественный состав в молекулах:
HCl , H2O, NH3, CH4.
–

Что общего в составе молекул?
– Чем они отличаются друг от друга?
Слайд 8Валентность – это число связей, которые атом образует с другими атомами.
Валентность обозначается
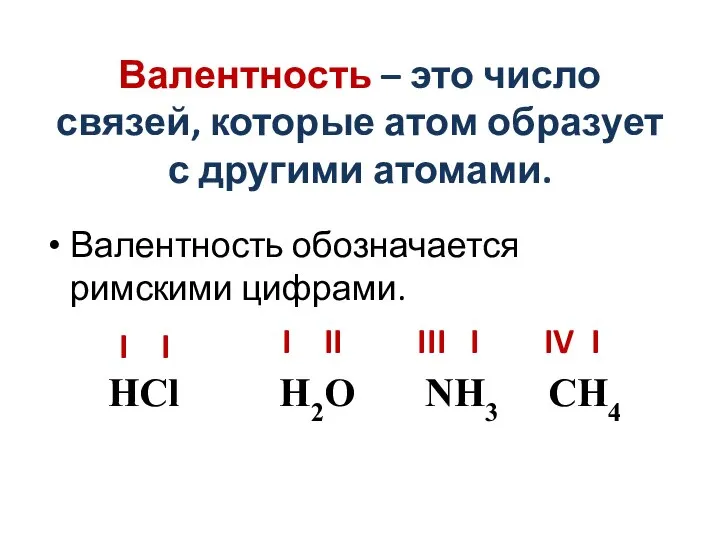
римскими цифрами.
НCl H2O NH3 CH4
I I
IV I
I II
III I
Слайд 9Эволюция понятия “валентность”
– В начале XIX века Дж. Дальтоном был сформулирован

закон кратных отношений, из которого следовало, что каждый атом одного элемента может соединяться с одним, двумя, тремя и т.д. атомами другого элемента (как, например, в рассмотренных нами соединениях атомов с водородом).
В середине XIX века, когда были определены точные относительные веса атомов (И.Я. Берцелиус и др.), стало ясно, что наибольшее число атомов, с которыми может соединяться данный атом, не превышает определённой величины, зависящей от его природы. Эта способность связывать или замещать определённое число других атомов и была названа Э.Франклендом в 1853 г. “валентность”.
Поскольку в то время для водорода не были известны соединения, где он был бы связан более чем с одним атомом любого другого элемента, атом водорода был выбран в качестве стандарта, обладающего валентностью, равной 1.
Слайд 10Эволюция понятия “валентность”
В конце 50-х гг. XIX вeка А.С. Купер и

А.Кекуле постулировали принцип постоянной четырёхвалентности углерода в органических соединениях. Представления о валентности составили важную часть теории химического строения А.М. Бутлерова в 1861 г.
Периодический закон Д.И. Менделеева в 1869 г. вскрыл зависимость валентности элемента от его положения в периодической системе.
Вклад в эволюцию понятия “валентность” в разные годы внесли В.Коссель, А.Вернер, Г.Льюис.
Начиная с 30-х гг. XX века представления о природе и характере валентности постоянно расширялись и углублялись. Существенный прогресс был достигнут в 1927 г., когда В.Гейтлер и Ф.Лондон выполнили первый количественный квантово-химический расчёт молекулы водорода H2.
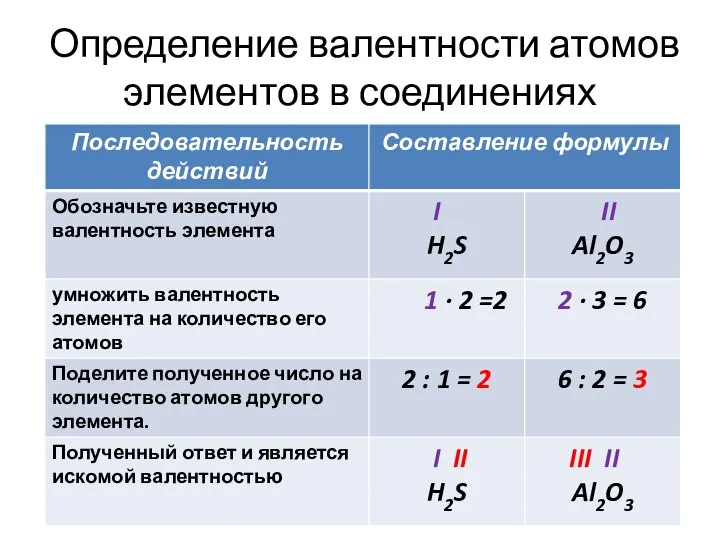
Слайд 11Определение валентности атомов элементов в соединениях









 Спирты. Классификация
Спирты. Классификация Обобщение и повторение за курс основной школы по химии. 9 класс
Обобщение и повторение за курс основной школы по химии. 9 класс Презентация на тему Степень окисления
Презентация на тему Степень окисления 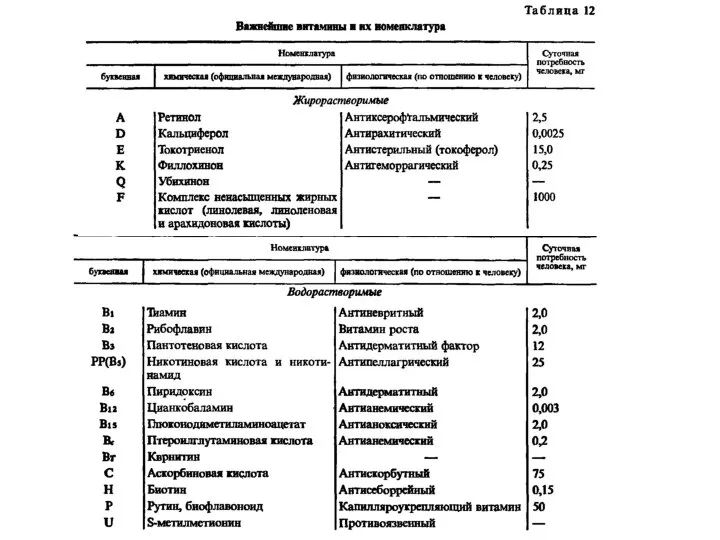 Важнейшие витамины и их номенклатура
Важнейшие витамины и их номенклатура Дисперсные системы
Дисперсные системы Молекулярно-механическое изнашивание
Молекулярно-механическое изнашивание Электролитическая диссоциация
Электролитическая диссоциация Степень окисления. Составление химических формул бинарных соединений
Степень окисления. Составление химических формул бинарных соединений Альфа и бета распад. Правило смещения
Альфа и бета распад. Правило смещения Алкадиены
Алкадиены Галогены
Галогены Железо – элемент побочной подгруппы YIII группы ПСХЭ Д.И.Менделеева. (по материалам ЕГЭ)
Железо – элемент побочной подгруппы YIII группы ПСХЭ Д.И.Менделеева. (по материалам ЕГЭ) Влияние катализаторов на реакционную систему на примере синтеза Фишера-Тропша
Влияние катализаторов на реакционную систему на примере синтеза Фишера-Тропша Адиабатическое приближение, потенциальные поверхности молекулярных систем, неадиабатические переходы
Адиабатическое приближение, потенциальные поверхности молекулярных систем, неадиабатические переходы Ацетиленовые углеводороды. Алкины
Ацетиленовые углеводороды. Алкины Комплексонометрическое титрование. Часть 1. Лекция 6
Комплексонометрическое титрование. Часть 1. Лекция 6 Сравнительная характеристика стиральных порошков
Сравнительная характеристика стиральных порошков Клей
Клей Интеллектуальная игра По страницам истории химии
Интеллектуальная игра По страницам истории химии Материалы к уроку «Значение растворов» Автор: учитель СОШ № 4 Чурбакова Елена Васильевна
Материалы к уроку «Значение растворов» Автор: учитель СОШ № 4 Чурбакова Елена Васильевна Белки. Структура белков
Белки. Структура белков Свойства веществ
Свойства веществ Получение функциональных плёнок на основе TiO2
Получение функциональных плёнок на основе TiO2 Жиры (липиды)
Жиры (липиды) Пероксид щелочных металлов
Пероксид щелочных металлов Свойства черных и цветных металлов
Свойства черных и цветных металлов Степень окисления. Бинарные соединения
Степень окисления. Бинарные соединения Электронная конфигурация атома
Электронная конфигурация атома