Содержание
- 2. Сегодня на уроке вы узнаете: Понятие о непредельных углеводородах. Характеристика тройной связи. Изомерия и номенклатура алкинов.
- 3. Понятие об алкинах Алкины – углеводороды, содержащие в молекуле одну тройную связь между атомами углерода, а
- 4. Характеристика тройной связи Вид гибридизации – sp Валентный угол – 180 Длина связи С = С
- 5. Схема образования sp -гибридных орбиталей
- 6. Схема образования sp -гибридных орбиталей
- 7. Гомологический ряд алкинов C2H2 C3H4 C4H6 C5H8 C6H10 C7H12 Этин Пропин Бутин Пентин Гексин Гептин
- 8. Изомерия алкинов Структурная изомерия 1. Изомерия положения тройной связи (начиная с С4Н6): СН ≡С−СН2−СН3 СН3−С≡С−СН3 бутин-1
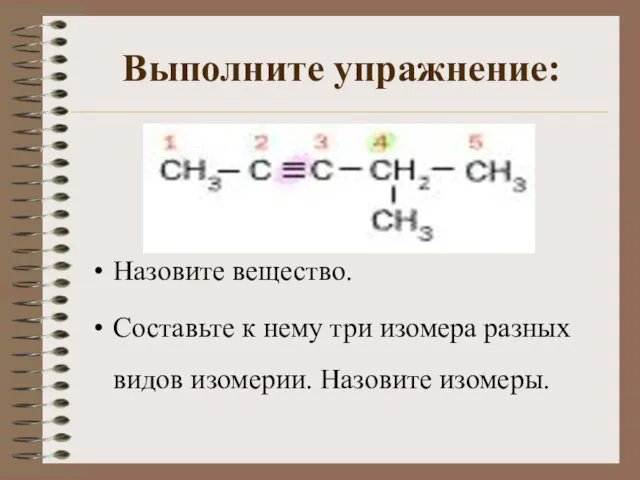
- 9. Выполните упражнение: Назовите вещество. Составьте к нему три изомера разных видов изомерии. Назовите изомеры.
- 10. Физические свойства Температуры кипения и плавления алкинов, так же как и алкенов, закономерно повышаются при увеличении
- 11. Ацетилен получают в промышленности двумя способами: 1. Термический крекинг метана: 1500°С 2СН4 ⎯⎯→ С2Н2 + 3Н2
- 12. Химические свойства алкинов Химические свойства ацетилена и его гомологов в основном определяются наличием в их молекулах
- 13. Реакции присоединения 1. Галогенирование Обесцвечивание бромной воды является качественной реакцией на все непредельные углеводороды
- 14. 2. Гидрогалогенирование. 3. Гидрирование. 4. Гидратация. HgSO4 Н−C≡C−H + H2O ⎯→ [H−C=C−H] ⎯→ CH3−C−H ⏐ ⏐
- 15. Окисление Ацетилен и его гомологи окисляются перманганатом калия с расщеплением тройной связи и образованием карбоновых кислот:
- 16. Горение ацетилена При сгорании (полном окислении) ацетилена выделяется большое количества тепла: HC≡CH + 2О2 ⎯→ 2СО2
- 17. Реакции замещения При взаимодействии ацетилена (или R−C≡C−H) с аммиачными растворами оксида серебра выпадают осадки нерастворимых ацетиленидов:
- 18. Реакция полимеризации 1. Димеризация под действием водного раствора CuCl и NH4Cl: НC≡CH + НC≡CH ⎯→ Н2C=CH−C≡CH
- 20. Скачать презентацию











![2. Гидрогалогенирование. 3. Гидрирование. 4. Гидратация. HgSO4 Н−C≡C−H + H2O ⎯→ [H−C=C−H]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/265819/slide-13.jpg)




 Презентация на тему Минеральные вещества
Презентация на тему Минеральные вещества  Коррозия металла
Коррозия металла Соль не только блюдо
Соль не только блюдо Устойчивость коллоидных лиофобных дисперсных систем. Теория ДЛФО. Лекция 14
Устойчивость коллоидных лиофобных дисперсных систем. Теория ДЛФО. Лекция 14 Биотит и тальк
Биотит и тальк Zirconium Dioxide
Zirconium Dioxide Ископаемые углеводороды
Ископаемые углеводороды Осторожно, химия
Осторожно, химия Презентация на тему Подгруппа азота
Презентация на тему Подгруппа азота  Комплексные соединения
Комплексные соединения Пакет заданий №2. Команда вечерний дозор
Пакет заданий №2. Команда вечерний дозор Омский государственный медицинский университет. Кафедра химии. Консультация. Дисциплина Биоорганическая химия
Омский государственный медицинский университет. Кафедра химии. Консультация. Дисциплина Биоорганическая химия Природный газ
Природный газ Кислород Общая характеристика, получение и свойства
Кислород Общая характеристика, получение и свойства Презентация на тему Нефть и способы ее переработки
Презентация на тему Нефть и способы ее переработки  Применение этилена на основе свойств
Применение этилена на основе свойств Минералы
Минералы Сравнительная характеристика стиральных порошков
Сравнительная характеристика стиральных порошков Генетическая связь веществ. Виды реакций
Генетическая связь веществ. Виды реакций Оценка качества пищевой соли, реализуемой в розничной торговле
Оценка качества пищевой соли, реализуемой в розничной торговле Презентация на тему Интерактивная игра "Химический лабиринт"
Презентация на тему Интерактивная игра "Химический лабиринт"  Путешествие в мир удивительных веществ Оксиды. Химия 8 класс
Путешествие в мир удивительных веществ Оксиды. Химия 8 класс Презентация на тему Окислительно-восстановительные реакции
Презентация на тему Окислительно-восстановительные реакции  Состав атома
Состав атома История чернил
История чернил Элемент Фосфор
Элемент Фосфор Предмет задачи, разделы, методы физической химии. Основные понятия и законы химической термодинамики
Предмет задачи, разделы, методы физической химии. Основные понятия и законы химической термодинамики В1 витамині
В1 витамині