Содержание
- 2. ОВТ Методы ОВТ применяют для определения окислителей и восстановителей. Окислитель – принимает электроны, сам восстанавливается: Ок
- 3. ОВТ В ходе ОВР образуется две сопряженные О-В пары: Ок1/Вос1 и Вос2/Ок2 Ок1 и Вос1 -
- 4. ОВТ В уравнении Нернста (при 25оС) R – универсальная газовая постоянная (8,31 Дж/моль К) Т –
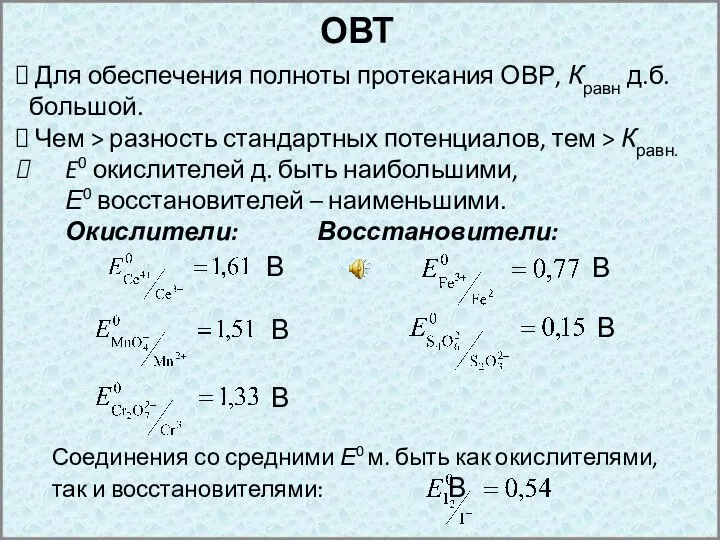
- 5. ОВТ Для обеспечения полноты протекания ОВР, Кравн д.б. большой. Чем > разность стандартных потенциалов, тем >
- 6. Условия полноты протекания ОВР «Полнота протекания» – реакция протекает не менее, чем на 99,9 %. Значит
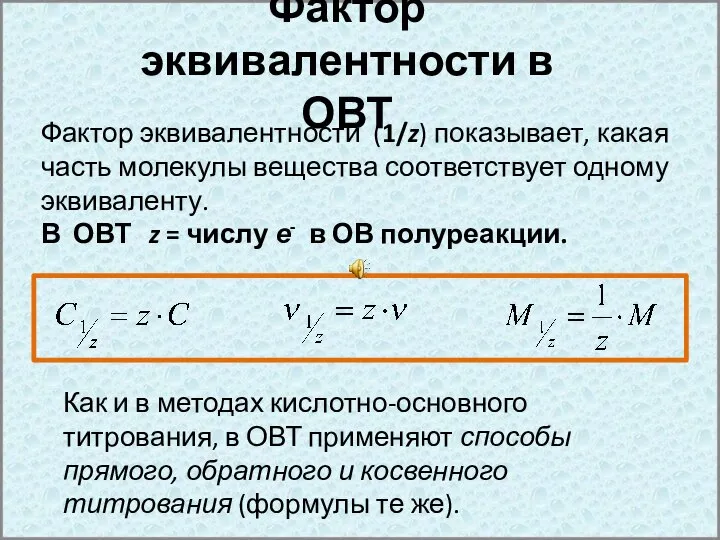
- 7. Фактор эквивалентности в ОВТ Фактор эквивалентности (1/z) показывает, какая часть молекулы вещества соответствует одному эквиваленту. В
- 8. Классификация методов ОВТ по используемому титранту
- 9. Перманганатометрия Титрант – KMnO4 - не является первичным стандартом, т.к. он - сильный окислитель (окисляет Н2О
- 10. Автокатализ – образующийся продукт реакции ускоряет саму реакцию. Катализатором реакции восстановления КMnO4 являются образующиеся ионы Mn2+
- 11. Фактор эквивалентности КMnO4 зависит от среды, в которой протекает реакция. В кислой среде: MnO4- + 8H+
- 12. Перманганатометрия Для определения восстановителей прямым титрованием: Fe2+ + MnO4- + H+ → Fe3+ + Mn2+ +
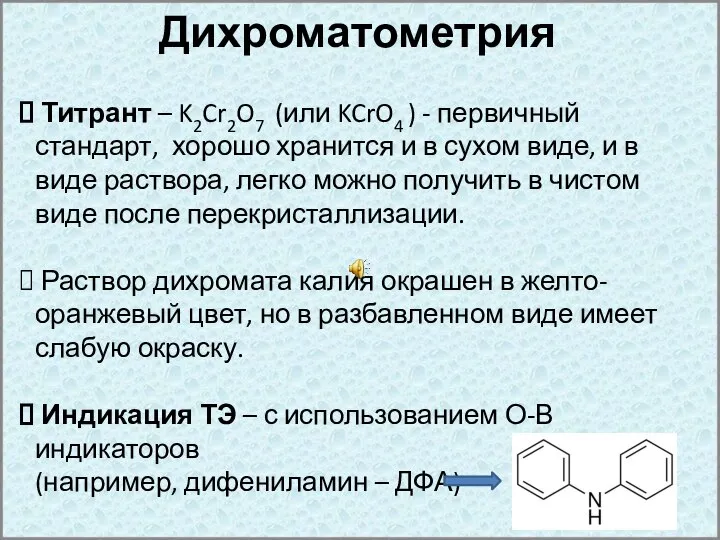
- 13. Дихроматометрия Титрант – K2Cr2O7 (или KCrO4 ) - первичный стандарт, хорошо хранится и в сухом виде,
- 14. Дихроматометрия Cr2O72- + 14H+ + 6e- → 2Cr3+ + 7H2O 1/z = 1/6 E0 = 1,33
- 15. Йодиметрия/йодометрия Титранты - растворы I2 и KI, Na2S2O3 Растворы йода, йодида и тиосульфата не являются первичными
- 16. Йодиметрия (титрант I2 – ок-ль) Для анализа пищевых продуктов, фармпрепаратов и в промышленном анализе (например, SO32-
- 17. ПРИМЕРЫ определения восстановителей прямым титрованием: H2S + I2 → S + 2I- + 2H+ (кисл. ср.)
- 18. Йодометрия (титрант I- – в-ль) Для титрования сильных окислителей. Для реакций с I- нет способа фиксирования
- 19. Йодометрия ПРИМЕРЫ титрования по замещению: Cr2O72- + I- + H+ → I2 + Cr3+ + H2O
- 20. Титрант – раствор бромата калия KBrO3 (первичный стандарт). Титрование с использованием необратимого О-В индикатора – метилового
- 21. Способы ускорения ОВР Нагревание Изменение кислотности среды Введение катализатора Кривые О-В титрования Это зависимости Е от
- 22. Способы индикации КТТ Специфические (крахмал в йодометрии) Окислительно-восстановительные Необратимые О-В индикаторы – необратимо окисляются и обесцвечиваются
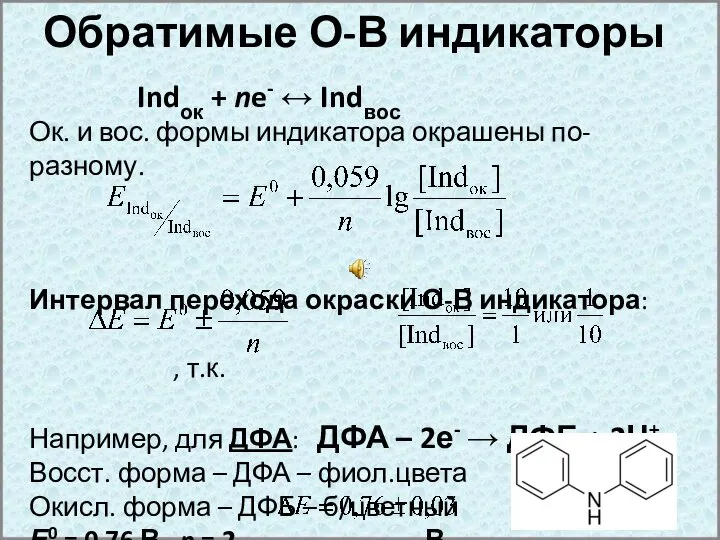
- 23. Обратимые О-В индикаторы Indок + ne- ↔ Indвос Ок. и вос. формы индикатора окрашены по-разному. Интервал
- 24. Правила выбора О-В индикаторов Е0 индикатора д. быть близок к Е в ТЭ. Интервал перехода окраски
- 25. Для построения кривых ОВТ рассчитывают значения Е системы в разные моменты титрования: до скачка титрования, в
- 26. Расчет кривых ОВТ
- 28. Скачать презентацию





















 Согласованное и несогласованное действие заместителей в бензольном кольце
Согласованное и несогласованное действие заместителей в бензольном кольце Окислительно-восстановительные реакции
Окислительно-восстановительные реакции ОСОБЕННОСТИ СТРОЕНИЯ, РЕАКЦИОННОЙ СПОСОБНОСТИ И МЕТОДЫ СИНТЕЗА АЛКИНОВ
ОСОБЕННОСТИ СТРОЕНИЯ, РЕАКЦИОННОЙ СПОСОБНОСТИ И МЕТОДЫ СИНТЕЗА АЛКИНОВ Общие химические свойства металлов
Общие химические свойства металлов Понятия и законы в химии. (Лекция 1)
Понятия и законы в химии. (Лекция 1) Полисахариды. Крахмал и целлюлоза
Полисахариды. Крахмал и целлюлоза Презентация на тему: Азотная кислота
Презентация на тему: Азотная кислота Процесс диссоциации
Процесс диссоциации Количество вещества
Количество вещества Углерод. Электронная формула
Углерод. Электронная формула Водородная химическая связь
Водородная химическая связь Металлы и неметаллы. Знакомство с периодической системой Д. И. Менделеева
Металлы и неметаллы. Знакомство с периодической системой Д. И. Менделеева Анодное растворение mn5si3-электрода в сернокислом фторидсодержащем электролите
Анодное растворение mn5si3-электрода в сернокислом фторидсодержащем электролите Техника безопасности при использовании различных видов топлива. Практическая работа № 3
Техника безопасности при использовании различных видов топлива. Практическая работа № 3 Срспальфа-олефинсульфанаттар
Срспальфа-олефинсульфанаттар Вещества простые и сложные
Вещества простые и сложные Карбонаты. Лекция 12
Карбонаты. Лекция 12 Промышленное получение аминокислот и их применение в медицине и диетологии
Промышленное получение аминокислот и их применение в медицине и диетологии Увлекательный мир химии
Увлекательный мир химии Валентность. Определение валентности по формулам
Валентность. Определение валентности по формулам Основы химической термодинамики
Основы химической термодинамики Теоретические основы метода потенциалов самопроизвольной поляризации - ПС
Теоретические основы метода потенциалов самопроизвольной поляризации - ПС Сера. Физические и химические свойства. Нахождение в природе
Сера. Физические и химические свойства. Нахождение в природе Презентация на тему Правила безопасности труда в кабинете химии
Презентация на тему Правила безопасности труда в кабинете химии  Химия в косметике
Химия в косметике Степень окисления веществ
Степень окисления веществ Алкины
Алкины Как работают наночастицы серебра и меди. Вся продукция AgBionika
Как работают наночастицы серебра и меди. Вся продукция AgBionika