Содержание
- 2. В 1887г. шведский учёный С. Аррениус для объяснения особенностей водных растворов веществ предложил теорию электролитической диссоциации.
- 3. Почётный член АН СССР (1932), одновременно и независимо от В. А. Кистяковского предложивший представление о сольватации
- 4. Современное содержание ТЭД можно свести к четырем основным положениям. I-е положение: Все вещества по их способности
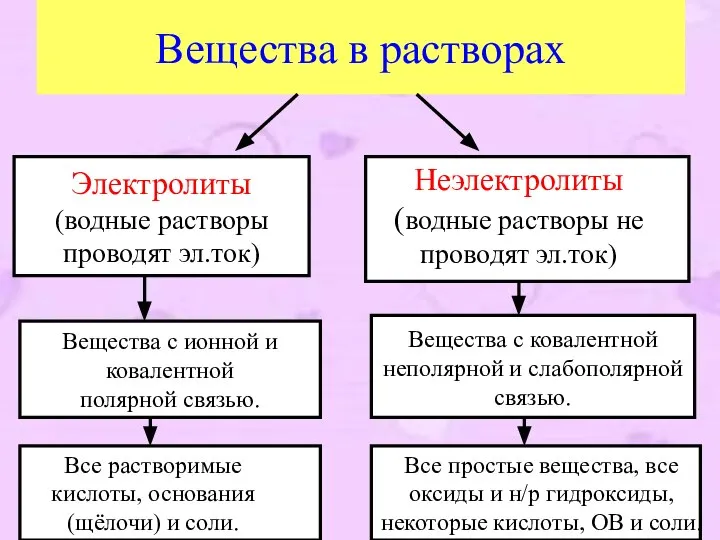
- 5. Вещества в растворах Электролиты (водные растворы проводят эл.ток) Неэлектролиты (водные растворы не проводят эл.ток) Вещества с
- 6. II-е положение ТЭД В растворах электролиты диссоциируют (распадаются) на положительные и отрицательные ионы. Процесс распада электролита
- 7. Типы ионов По заряду: катионы (положительные) и анионы (отрицательные); По отношению к воде: гидратированные и негидратированные
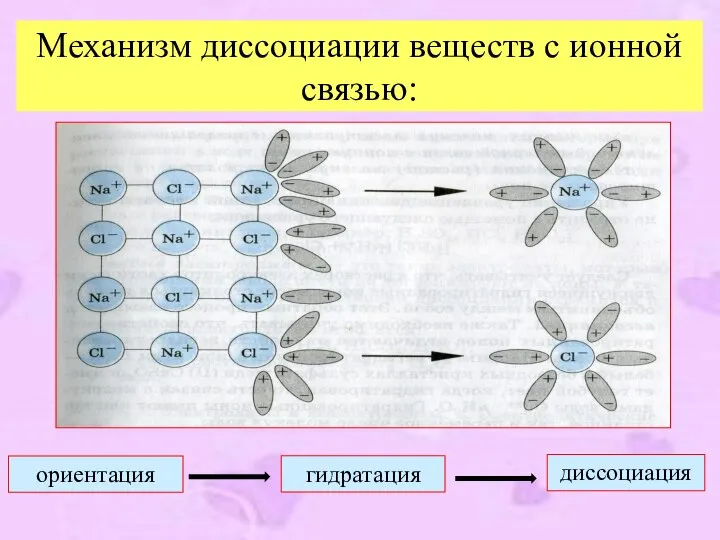
- 8. Механизм диссоциации веществ с ионной связью: диссоциация ориентация гидратация
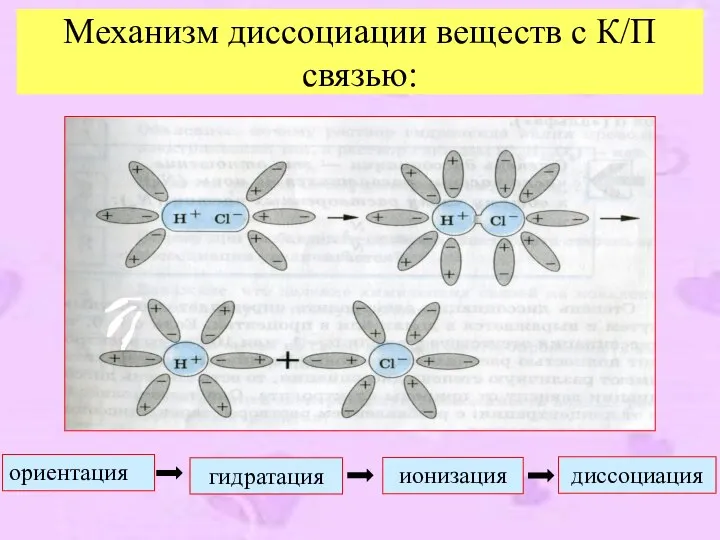
- 9. Механизм диссоциации веществ с К/П связью: диссоциация ориентация гидратация ионизация
- 10. Модельная схема диссоциации соли NaCl = + Na +
- 11. КИСЛОТЫ С ПОЗИЦИИ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ Кислоты – это электролиты, которые диссоциируют на катионы водорода и анионы
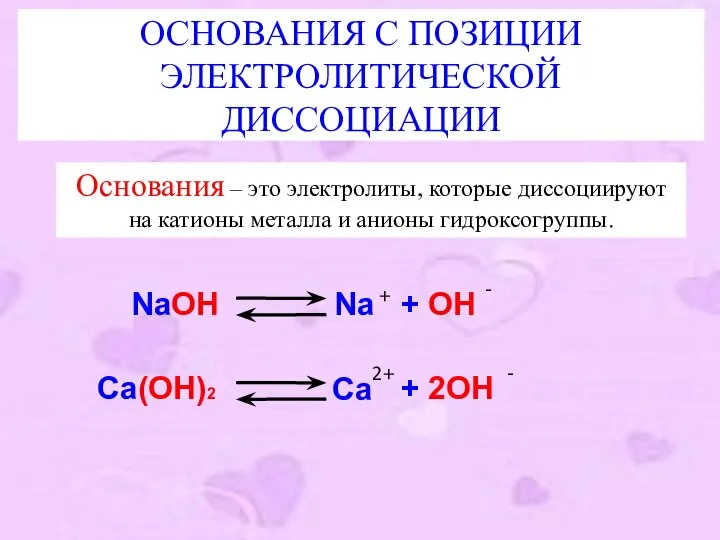
- 12. ОСНОВАНИЯ С ПОЗИЦИИ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ Основания – это электролиты, которые диссоциируют на катионы металла и анионы
- 13. СОЛИ С ПОЗИЦИИ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ Соли – это электролиты, которые диссоциируют на катионы металла и анионы
- 14. Сила электролита Сила электролита - способность образовывать ионы. Степень диссоциации выражается отношением числа распавшихся на ионы
- 15. Силу кислородсодержащих кислот можно определить по следующему правилу: HnROm если m - n = 0 очень
- 16. Zn + 2CH3COOH → (CH3COO)2 Zn + H2↑ наблюдаем выделение водорода. При добавлении в пробирку твердого
- 18. Скачать презентацию











 proverochnaya_zadachi_1_ball_-_kopia (1)
proverochnaya_zadachi_1_ball_-_kopia (1) Химические вещества, используемые при пайке
Химические вещества, используемые при пайке Азот, соединения азота
Азот, соединения азота Теория электролитической диссоциации
Теория электролитической диссоциации Топливо и расчеты его горения
Топливо и расчеты его горения Научно-исследовательская деятельность учащихся в процессе изучения химии
Научно-исследовательская деятельность учащихся в процессе изучения химии Водород в природе. Получение водорода и его физические свойства. 8 класс
Водород в природе. Получение водорода и его физические свойства. 8 класс Кристаллическое состояние воды - лёд
Кристаллическое состояние воды - лёд Способы получения металлов
Способы получения металлов Концентрации растворов и эквиваленты веществ
Концентрации растворов и эквиваленты веществ Презентация на тему Кислород
Презентация на тему Кислород  Интрузивные контакты. Контакты интрузивных и осадочных пород
Интрузивные контакты. Контакты интрузивных и осадочных пород Супер-химия. Викторина
Супер-химия. Викторина Вычисление массовой доли химического элемента в веществе
Вычисление массовой доли химического элемента в веществе Теория строения вещества. Межмолекулярные взаимодействия. Водородная связь. Специфические взаимодействия
Теория строения вещества. Межмолекулярные взаимодействия. Водородная связь. Специфические взаимодействия Липиды. Классификация липидов
Липиды. Классификация липидов Белки
Белки Моносахариды
Моносахариды Химическая термодинамика
Химическая термодинамика Элементы vi группы главной подгруппы. Халькогены (рождающие руды)
Элементы vi группы главной подгруппы. Халькогены (рождающие руды) Карбоновые кислоты
Карбоновые кислоты Карбоновые кислоты
Карбоновые кислоты Магний (Mg, Magnesium). Общая характеристика магния
Магний (Mg, Magnesium). Общая характеристика магния Фосфор - светоносный
Фосфор - светоносный Элементарный химический состав белков
Элементарный химический состав белков Биохимия витаминов и коферментов
Биохимия витаминов и коферментов Способы получения металлов
Способы получения металлов Презентация на тему Степень окисления (8 класс)
Презентация на тему Степень окисления (8 класс)